��Ŀ����
����Ŀ���о�������NOx��SO2����������Ҫ�ɷ֡�NOx��Ҫ��Դ������β����
��֪��N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
��1������β��ת�����з����ķ�ӦΪ��2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)���˷�Ӧ��H =__________kJ��mol��1
N2(g) + 2CO2(g)���˷�Ӧ��H =__________kJ��mol��1
��2��T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ���̣�0��15min����NO�����ʵ�����ʱ��仯�Ĺ�ϵ����ͼһ��ʾ��
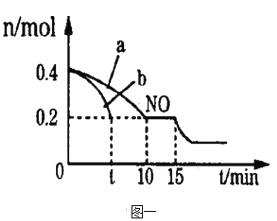
��T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K��_______________��ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol��ƽ�⽫_______�ƶ���������������������������������
��ͼ��a��b�ֱ��ʾ��һ���¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n(NO)�ı仯���ߣ����б�ʾ����������ϴ��������__________������a������b������
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı��һ������������_____________________��
A������CO��Ũ�� B�������¶� C������ѹǿ D������ʱ����He
��3��Ϊ̽���¶ȼ���ͬ�����Է�Ӧ2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)��Ӱ�죬�ֱ��ڲ�ͬ�¶ȡ���ͬ�����£�����������ʼ���������ظ�ʵ�飬����ͬʱ���ڲ��N2Ũ�ȱ仯�������ͼ����ʾ������˵����ȷ����__________________ ��
N2(g) + 2CO2(g)��Ӱ�죬�ֱ��ڲ�ͬ�¶ȡ���ͬ�����£�����������ʼ���������ظ�ʵ�飬����ͬʱ���ڲ��N2Ũ�ȱ仯�������ͼ����ʾ������˵����ȷ����__________________ ��
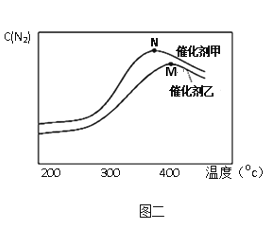
A������ͬ�¶��´����������·�Ӧ��ƽ�ⳣ���ȴ�����ʱ��
B����Ӧ��M��ﵽƽ�⣬�˺�N2Ũ�ȼ�С��ԭ��������¶����ߣ�ƽ�������ƶ�
C��N���N2Ũ�ȼ�С��ԭ��������¶����߷����˸���Ӧ
D��N���N2Ũ�ȼ�С��ԭ��������¶����ߴ������Խ�����
���𰸡� ��746.50 5L/mol ���� b AC CD
��������������������⿼���˹���ɵ�Ӧ�ã���ѧƽ�ⳣ���ļ����Ӧ������ѧƽ��ͼ��ķ�������������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�졣
��1���Է�Ӧ��ţ�N2��g����O2��g��![]() 2NO��g����H����180.50 kJ/mol����ʽ��
2NO��g����H����180.50 kJ/mol����ʽ��
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00 kJ/mol����ʽ��
2 CO2��g�� ��H����566.00 kJ/mol����ʽ��
Ӧ�ø�˹��������ʽ-��ʽ��2NO��g��+2CO��g��![]() N2��g��+2CO2��g����H=-566.00kJ/mol-��+180.50kJ/mol��=-746.50kJ/mol��
N2��g��+2CO2��g����H=-566.00kJ/mol-��+180.50kJ/mol��=-746.50kJ/mol��
��2������ͼ֪NO��ʼ���ʵ���Ϊ0.4mol��10~15minNO���ʵ������䣬˵��ƽ��ʱNO���ʵ���Ϊ0.2mol��������ʽ
2NO��g��+2CO��g��![]() N2��g��+2CO2��g��
N2��g��+2CO2��g��
c����ʼ����mol/L�� 0.2 0.2 0 0
c��ת������mol/L�� 0.1 0.1 0.05 0.1
c��ƽ�⣩��mol/L�� 0.1 0.1 0.05 0.1
�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =
=![]() =5��L/mol���������������г���CO��N2��0.8mol��˲ʱCO��NO��N2��CO2���ʵ���Ũ������Ϊ0.5mol/L��0.1 mol/L��0.45 mol/L��0.1 mol/L����ʱŨ����Ϊ
=5��L/mol���������������г���CO��N2��0.8mol��˲ʱCO��NO��N2��CO2���ʵ���Ũ������Ϊ0.5mol/L��0.1 mol/L��0.45 mol/L��0.1 mol/L����ʱŨ����Ϊ![]() =1.8
=1.8![]() 5��ƽ�⽫�����ƶ���
5��ƽ�⽫�����ƶ���
����ͼ֪b�ﵽƽ������ʱ��̣�b��Ӧ���ʿ죬���������Խ��Ӧ����Խ�죬��ʾ����������ϴ��������b��
��A�����CO��Ũ�ȣ�ƽ��������Ӧ�����ƶ���NO���ʵ�����С����ȷ��B������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO���ʵ���������C�����ѹǿ��ƽ��������Ӧ�����ƶ���NO���ʵ�����С����ȷ��D�����ʱ����He�����ڸ����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���NO���ʵ������䣬����ѡAC��
��3��A�ƽ�ⳣ��ֻ���¶��йأ�������أ�����ͬ�¶��´����������·�Ӧ��ƽ�ⳣ�����������������ȣ�����B�ͼ�����߱�ʾ������ͬʱ����N2Ũ�ȱ仯�����ͼ�������о������¶��������Ի�ѧ��Ӧ���ʵ�Ӱ�죬M����¶�������ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����߷����˸���Ӧ���¶����ߴ������Խ��ͣ�������C�N��������¶���ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����߷����˸���Ӧ����ȷ��D�N��������¶���ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����ߴ����Ļ��Խ��ͣ��Ҵ�ʱ�����Է�Ӧ���ʵ�Ӱ��ռ�������ã���ȷ����ѡCD��

 ����������ϵ�д�
����������ϵ�д�����Ŀ������β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1����֪��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H=��746.5kJ/mol
2CO2(g)+N2(g) ��H=��746.5kJ/mol
2C(s)+O2(g)![]() 2CO(g) ��H=��221 kJ/mol
2CO(g) ��H=��221 kJ/mol
C(s)+O2(g)![]() CO2(g) ��H=��393.5 kJ/mol
CO2(g) ��H=��393.5 kJ/mol
��N2(g)+O2(g)�T2NO(g) ��H=____________ kJ/mol
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO��/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
c��CO��/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
��C2�Ϻ�������ֵΪ_________������ĸ��ţ�
A.4.20 B.4.00 C.2.95 D.2.85
��3������ͬ���ʵ�����H2O(g)��CO(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��H2O(g)+CO2(g) ![]() CO2(g)+H2(g)�õ������������ݣ�
CO2(g)+H2(g)�õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | C | d | 1 |
��a=2��b=1����c=____������ʵ���Ӧƽ�ⳣ���Ĺ�ϵK(i)_____ K(ii) _____ K(iii)�����������������=������
��4�����Ʒ�Ӧ������CO��H2���������ϳɼ״��Ͷ����ѣ����кϳɶ����ѵĻ�ѧ����ʽΪ��3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)������ͬ�����ºϳɶ����Ѻͺϳɼ״���ԭ��ƽ��ת��������̼��
CH3OCH3(g)+CO2(g)������ͬ�����ºϳɶ����Ѻͺϳɼ״���ԭ��ƽ��ת��������̼��![]() �ı仯��ͼ��ʾ��
�ı仯��ͼ��ʾ��

�ٺϳɶ����ѵ������̼��Ϊ__________��
�ڼ״�ʹ�ò����ᵼ����Ⱦ�����õ�ⷨ����������Ⱦ����ԭ���ǵ��CoSO4��ϡ�����CH3OH�Ļ����Һ����Co2+����ΪCo3+��Co3+�ٽ�CH3OH������CO2��Co3+����CH3OH�����ӷ���ʽΪ________________��

