题目内容
【题目】按要求填空:
I.(1)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至__。
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至__。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为__,由水电离出的c(OH-)=__mol·L-1。
(3)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为__。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1molL-1HA溶液中逐滴加入0.1000molL-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是__点,滴定过程中宜选用__作指示剂,滴定终点在__(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为___mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
【答案】5 CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH- 10-3 1:10 c 酚酞 c点以上 AD 0.1050
H2CO3+OH- 10-3 1:10 c 酚酞 c点以上 AD 0.1050
【解析】
I.(1)Cr(OH)3的溶度积Ksp=10-32= c(Cr3+) c3 (OH-),要使c(Cr3+)完全沉淀,应使c(Cr3+)降至10-5 mol/L,根据溶度积常数以及水的离子积常数来进行计算;
(2)碳酸钠是强碱弱酸盐,水解呈碱性;
(3)根据酸碱混合后溶液的pH进行计算;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。
(2)根据c(待测)=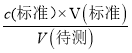 分析;
分析;
(3)根据数据的有效性舍去第3组数据,则1、2组平均消耗V(NaOH)=![]() =21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。
=21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。
I.(1)Cr(OH)3的溶度积Ksp=10-32= c(Cr3+) c3 (OH-),当c(Cr3+)=10-5mol/L时,溶液的c (OH-)=![]() mol/L=10-9 mol/L,c(H+)=
mol/L=10-9 mol/L,c(H+)=![]() mol/L=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
mol/L=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(2)25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,是由于碳酸钠是强碱弱酸盐,在溶液中CO32-发生水解反应,消耗水电离产生的H+,促进了水的电离平衡正向移动,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性,其水解方程式为CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-,pH=11,c(H+)=10-11mol/L, c(OH-)=10-3 mol/L,由于水电离产生的氢离子与氢氧根离子的浓度相等,所以由水电离出的c(OH-)=10-3mol/L;
H2CO3+OH-,pH=11,c(H+)=10-11mol/L, c(OH-)=10-3 mol/L,由于水电离产生的氢离子与氢氧根离子的浓度相等,所以由水电离出的c(OH-)=10-3mol/L;
(3)在100℃下,设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=10的NaOH溶液中,氢氧根离子的浓度为:10-2mol/L,pH=3的硫酸溶液中氢离子浓度为:10-3mol/L,二者混合后溶液的pH=7,溶液呈碱性,溶液中氢氧根离子的浓度为10-5mol/L,即氢氧化钠过量,即10-2mol/L×xL=10-3mol/L×y+10-5mol/L×(x+y),
解得x:y=1:10;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性围内变色的指示剂酚酞。滴定终点应在c点以上;
(2)A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=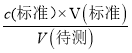 ,可以知道测定c(HA)偏大,选项A正确;
,可以知道测定c(HA)偏大,选项A正确;
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定,被滴定的HA溶质的量不变,对结果没有影响,选项B错误;
C.滴定过程中,溶液出现变色后,立即停止滴定,相当于标准液的体积偏小,根据c(待测)=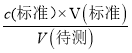 ,可以知道测定c(HA)偏小,选项C错误;
,可以知道测定c(HA)偏小,选项C错误;
D.滴定结束后,仰视液面,读取NaOH溶液体积,造成V(标准)偏大,根据c(待测)=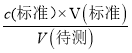 ,可以知道测定c(HA)偏大,选项D正确。
,可以知道测定c(HA)偏大,选项D正确。
故答案为AD;
(3)根据数据的有效性舍去第3组数据,则1、2组平均消耗V(NaOH)=![]() =21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。
=21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。