题目内容
【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
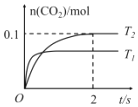
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
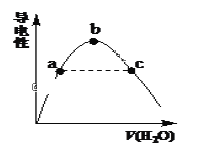
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________
【答案】10-6 (a-0.1) c>b>a > a<d<c<b ClO﹣+H2O+CO2=HCO3﹣+HClO
【解析】
(1)CH3COONa的水解平衡常数Kh= 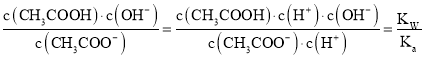 ,由此求解;
,由此求解;
(2)①溶液体积越大,醋酸电离程度越大;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大;
(3)①弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
②次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸。
(1)由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,所以c(CH3COO-)=c(Na+)=0.05mol/L,所以Ka=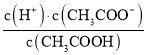 =
=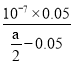 ,而CH3COONa的水解平衡常数Kh=
,而CH3COONa的水解平衡常数Kh=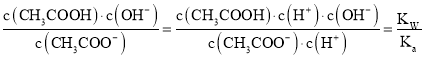 =
=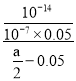 =10-6(a-0.1);
=10-6(a-0.1);
(2)①溶液体积越大,醋酸电离程度越大,根据图知,溶液体积:a<b<c,则醋酸电离程度:c>b>a;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大,溶液中c(CH3COO-):a>c,则c(NH4+):a>c,所以a点溶液中的c(CH3COO-)>c点溶液中的c(NH4+);
(3)①据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,则pH由小到大排列顺序是a<d<c<b;
②酸性:HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:ClO-+H2O+CO2=HCO3-+HClO。

 阅读快车系列答案
阅读快车系列答案