题目内容
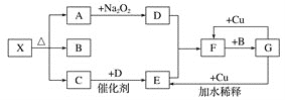
【题目】高铁酸钾(K2FeO4)是优良的多功能、绿色水处理剂。制备高铁酸钾的装置如图:
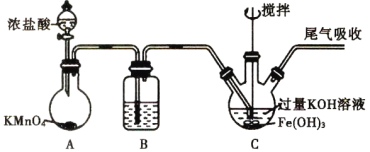
资料:①K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中比较稳定。②制备K2FeO4的反应为放热反应。下列叙述正确的是
A.装置A中的KMnO4可以用MnO2代替
B.装置B中的试剂为饱和碳酸氢钠溶液,目的是除去C12中的HC1
C.装置C中生成K2FeO4的关键操作是要缓慢通入Cl2且不能过量
D.K2FeO4做水处理剂时能杀菌消毒、吸附悬浮物与Cl2作用相同
【答案】C
【解析】
装置A为氯气的制备装置,装置B除去氯气中混有HCl气体,氯气进入装置C后与KOH和Fe(OH)3混合溶液反应制备高铁酸钾。
A.MnO2与浓盐酸制备氯气需要加热,该装置没有加热装置,所以不能用二氧化锰代替高锰酸钾,故A错误;
B.饱和碳酸氢钠会和HCl反应生成二氧化碳,二氧化碳可以和KOH反应,影响高铁酸钾的制备,故B错误;
C.氯气通入速率过快反应过快方出大量的热,会使高铁酸钾分解,而氯气过量会使溶液显酸性,从而造成高铁酸钾的分解,故C正确;
D.K2FeO4具有强氧化性,能杀菌消毒,能产生Fe3+从而生成氢氧化铁胶体吸附杂质,氯气消毒并不能吸附杂质,故D错误;
故答案为C。

【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
①写出NO2和NH3反应生成N2和液态水的热化学反应方程式______。
②反应Ⅰ中各物质所含化学键键能总和数据如下表,a=______。
物质 | N2 | O2 | NO |
每摩尔物质所含键能总和/kJ·mol-1 | 946 | 498 | 630 |
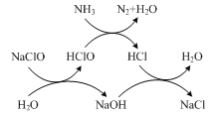
(2)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为______。
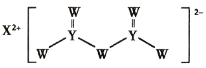
(3)某微生物膜技术能利用电解原理将弱碱性水中的NO![]() 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
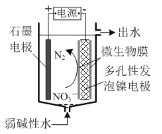
①写出阴极的电极反应式:______。
②理论上,若除去0.04 mol NO![]() ,阳极生成气体的体积为______。(标准状况)
,阳极生成气体的体积为______。(标准状况)