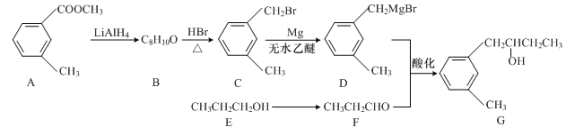
题目内容
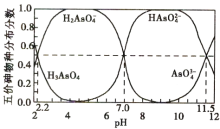
【题目】25℃时,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
下列叙述错误的是
A.将NaOH溶液逐滴加入到H3AsO4溶液中,当溶液pH在5~6时发生反应的离子方程式为![]()
B.Na2HAsO4溶液中离子浓度关系c(Na+)>c(HAsO![]() )>c(OH-)>c(H2AsO
)>c(OH-)>c(H2AsO![]() )>c(AsO
)>c(AsO![]() )
)
C.向H3AsO4溶液滴加NaOH溶液至中性时c(Na+)=2c(HAsO![]() )+3c(AsO
)+3c(AsO![]() )
)
D.AsO43-第一步水解的平衡常数的数量级为10-3
【答案】C
【解析】
A.当溶液pH在5~6时,H2AsO![]() 的分布分数由1开始降低,HAsO
的分布分数由1开始降低,HAsO![]() 的分布分数由0开始增加,故发生反应
的分布分数由0开始增加,故发生反应![]() ,A正确;
,A正确;
B.当pH=11.5时,c(HAsO![]() )=c(AsO43-),求得
)=c(AsO43-),求得![]() ,则HAsO
,则HAsO![]() 的电离程度小于AsO
的电离程度小于AsO![]() 的水解程度,Na2HAsO4溶液显碱性,c(H2AsO
的水解程度,Na2HAsO4溶液显碱性,c(H2AsO![]() )>c(AsO
)>c(AsO![]() ),同时水也电离出氢氧根离子,故c(Na+)>c(HAsO
),同时水也电离出氢氧根离子,故c(Na+)>c(HAsO![]() )>c(OH-)>c(H2AsO
)>c(OH-)>c(H2AsO![]() )>c(AsO
)>c(AsO![]() ),B正确;
),B正确;
C.向H3AsO4溶液滴加NaOH溶液至中性,溶液中存在[H+]=[OH-]、c(HAsO![]() )=c(H2AsO
)=c(H2AsO![]() ),根据电荷守恒c(Na+)=2c(HAsO
),根据电荷守恒c(Na+)=2c(HAsO![]() )+ c(H2AsO
)+ c(H2AsO![]() ),C错误;
),C错误;
D.当pH=11.5时,c(HAsO![]() )=c(AsO43-),求得
)=c(AsO43-),求得![]() ,则AsO43-第一步水解的平衡常数
,则AsO43-第一步水解的平衡常数![]() ,数量级为10-3,D正确;
,数量级为10-3,D正确;
答案选C。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
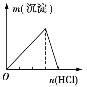
【题目】下列实验与图象对应的是
选项 | A | B | C | D |
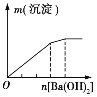
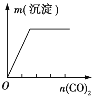
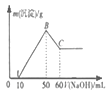
实验 | NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
图象 |
|
|
|
|
A. AB. BC. CD. D