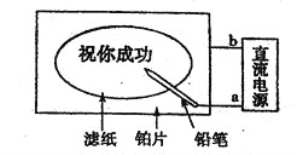
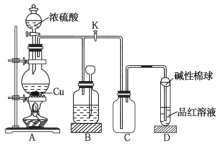
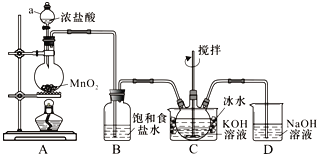
题目内容
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
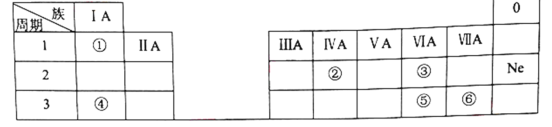
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
【答案】C < 共价键 Ag++Cl-=AgCl↓
【解析】
根据元素在周期表中的位置分析元素的种类;根据元素周期律及元素性质分析解答。
根据元素周期表的结构及元素在周期表中的位置分析知,①为氢,②为碳,③为氧,④为钠,⑤为硫,⑥为氯;
(1)碳的元素符号是C,故答案为:C;
(2)⑤和⑥处于相同周期,同周期元素随核电荷数增大,非金属性增强,则两种元素的非金属性强弱关系是:⑤<⑥,故答案为:<;
(3)H和O两种元素组成的化合物中有H2O和H2O2,都属于共价化合物,含有的化学键为共价键,故答案为:共价键;
(4)Na和Cl两种元素组成的化合物为NaCl,与AgNO3溶液反应生成氯化银沉淀和硝酸钠,离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓。

【题目】某菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反应的不溶性杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
开始沉淀时的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀时的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙烧炉中生成的气体A的成分有__(填化学式)。
(2)气体A可用于制取纯碱,其制取过程如图所示:
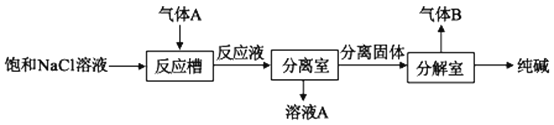
反应槽中有沉淀产生,该沉淀是__(填化学式),生成该沉淀的离子反应方程式为___,气体B的化学式为___。
(3)净化室中的除杂包含三步:
①加入少量MnO2将Fe2+转化为Fe3+,其反应的离子方程式为___;
②加氨水调pH=5.6,生成的沉淀的化学式是__;
③加入适量NH4F,将作为杂质的剩余金属阳离子转化为难溶于水的沉淀除去。
(4)净化液中含有的离子主要有__。
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
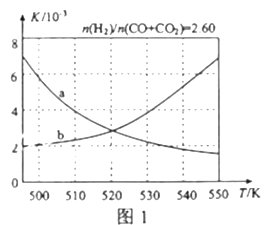
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.