题目内容
5.下列有关钢铁腐蚀与防护的说法错误的是( )| A. | 生铁比纯铁容易生锈 | |
| B. | 钢铁的腐蚀生成疏松氧化膜,不能保护内层金属 | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e→4OH- | |
| D. | 为保护地下钢管不受腐蚀,可使其与直流电源正极相连 |
分析 A.作原电池负极的金属加速被腐蚀;
B.钢铁和空气、水能构成原电池导致钢铁被腐蚀,生成疏松的氧化铁;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护.
解答 解:A.生铁中含有C、Fe,生铁和电解质溶液构成原电池,Fe作负极而加速被腐蚀,纯铁不易构成原电池,所以生铁比纯铁易生锈,故A正确;
B.钢铁和空气、水能构成原电池导致钢铁被腐蚀,钢铁的腐蚀生成疏松氧化膜不能隔绝空气,所以不能保护内层金属,故B正确;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故C正确;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护,为保护地下钢管不受腐蚀,可使其与直流电源负极相连,故D错误;
故选D.
点评 本题考查金属腐蚀与防护,明确原电池和电解池原理即可解答,知道钢铁发生析氢腐蚀、吸氧腐蚀发生的电极反应,知道如何采用化学方法保护金属,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
16.关于反应 14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4下列说法正确的是( )
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
13.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
20.氮化硅是一种高温陶瓷材料,其硬度大、熔点高,下列晶体熔化(或升华)时所克服的微粒间作用力都与氮化硅相同的是( )
| A. | 白磷、硅 | B. | 碳化硅、硫酸钠 | C. | 水晶、金刚石 | D. | 碘、汞 |
17.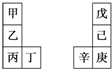 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子序数相差3 | |
| B. | 气态氢化物的热稳定性:戊>己>庚 | |
| C. | 乙所在周期元素中,其简单离子的半径最大 | |
| D. | 乙的单质在空气中燃烧生成的化合物只含离子键 |
15.某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-,现进行如下实验:
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出.将溶液分为3份.
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清.加热,将湿润的红色石蕊试纸置于试管口,未见明显现象.
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色.
则下列推断正确的是( )
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出.将溶液分为3份.
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清.加热,将湿润的红色石蕊试纸置于试管口,未见明显现象.
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色.
则下列推断正确的是( )
| A. | 溶液中一定有K+、Br-、CO32-、AlO2- | |
| B. | 溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ | |
| C. | 不能确定溶液中是否有K+、SO42-、Cl- | |
| D. | 往第3份溶液中滴加BaCl2可确认是否有SO42- |

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
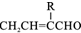
 .
. .
.
 .
. ,则R有4种.
,则R有4种.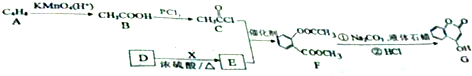
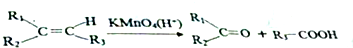
 .
.