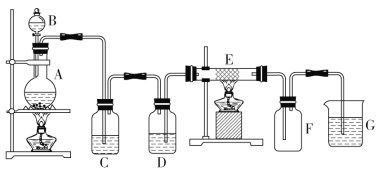
题目内容
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____FeS2+_____H++_____N![]() =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
【答案】3;8;2;3;6;2;4 FeS2 C Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
【解析】
(1)FeS2中铁元素化合价为+2价,硫元素化合价为-1价,反应中,Fe元素化合价由+2价升高为+3价被氧化,S元素化合价由-1价升高为0价被氧化,FeS2做还原剂,N元素化合价由+5价降低为+2价被还原,硝酸做氧化剂;
(2)依据Fe3+的性质分析判断;
(3)同种氧化剂,还原性强的先反应,由还原性Fe2+>Br-可知,向FeBr2溶液中通入Cl2时,还原性强的Fe2+离子先反应。
(1)FeS2中铁元素化合价为+2价,硫元素化合价为-1价,由未配平的化学方程式可知,反应中,Fe元素化合价由+2价升高为+3价被氧化,S元素化合价由-1价升高为0价被氧化,FeS2做还原剂,N元素化合价由+5价降低为+2价被还原,硝酸做氧化剂,反应的离子方程式为3FeS2+8H++2NO3-=3Fe2++6S↓+2NO↑+4H2O;
(2)①Fe与FeCl3溶液反应生成氯化亚铁,溶液由棕黄色变为浅绿色,故正确;
②KSCN溶液与FeCl3溶液反应生成Fe(SCN)3,溶液由棕黄色变为红色,故正确;
③硫酸铜为蓝色溶液,硫酸铜与氯化铁不反应,溶液不会变成无色,故错误;
④硝酸银与氯化铁反应生成氯化银沉淀,白色沉淀为氯化银,该性质是氯离子性质,不是Fe3+的性质,故错误;
⑤氢氧化钠溶液与FeCl3溶液反应生成红褐色的氢氧化铁沉淀,故正确;
③和④错误,故答案为:C;
(3)由还原性Fe2+>Br-可知,向FeBr2溶液中通入Cl2时,还原性强的Fe2+离子先反应,反应的离子方程式为为2Fe2++Cl2=2Fe3++2Cl-,标准状况下2.24 L氯气的物质的量为0.1mol,1L 0.2mol·L-1的FeBr2溶液中Fe2+的物质的量为0.2mol,由方程式可知0.1mol氯气与0.2mol亚铁离子恰好完全反应,Br-离子未参加反应。

【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A.达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时υ正>υ逆
B.两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C.反应过程中,容器Ⅰ与容器Ⅱ中的总压强之比为3∶1
D.温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立