题目内容
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol硝基(-NO2)与46gNO2所含的电子数均为23NA
B.1mol环己烷中含有共价键数为12NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,转移的电子数为NA
D.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
【答案】A
【解析】
A. 1mol硝基(-NO2)中含有的电子数为23NA,46gNO2的物质的量为1mol,含有的电子数为23NA,A正确;
B. 环己烷的结构简式为: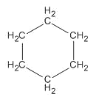 ,1mol环己烷中含有共价键数为18NA,B错误;
,1mol环己烷中含有共价键数为18NA,B错误;
C. 向FeI2溶液中通入适量Cl2,先将碘离子氧化,然后将亚铁离子氧化,当有1molFe2+被氧化时,共转移的电子的数目大于NA,C错误;
D. 电解精炼铜时,由于粗铜中含有锌、镍等金属,阳极上放电的不只是铜,所以转移NA个电子,则阳极质量减小不是32g,D错误;故答案为:A。

 名校课堂系列答案
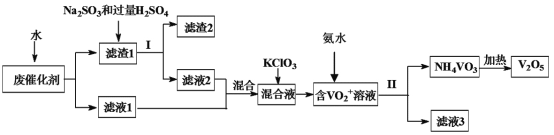
名校课堂系列答案【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如图:
已知:(1)部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)VO2++OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,在不加试剂情况下,可以采取的措施为__(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为__(填离子符号)。
(3)每生成1mol(VO2)2SO4时转移电子的数目为___。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为___。
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__。
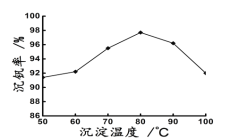
(6)新工艺流程的最后,钒以NH4VO3的形式沉淀出来;如图中横坐标表示反应II的温度,纵坐标表示沉钒率,沉钒率是指NH4VO3沉淀中V元素的质量和废催化剂中V元素的质量之比,也即是钒的回收率。请解释图中温度超过80℃以后,沉钒率下降的可能原因是___。
(7)该工艺流程中可以循环利用的物质为__。
(8)若实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100克该废钒催化剂按工业生产的步骤进行实验。当加入100mL0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设与KClO3反应后的操作步骤中钒没有损失,则该实验中钒的回收率是__(保留3位有效数字)。
【题目】I. CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
II. T1温度下,体积为2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) ![]() 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)当反应达到平衡后,其他条件不变,分离出部分M,则新平衡时,正反应速率相对于原平衡____________(填“增大”、“减小”、或“不变”)。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些____。

a.Y的逆反应速率
b.M的体积分数
c.混合气体的密度
d.X的转化率
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.重新达平衡后,用X表示的υ(正)比原平衡大
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度____________1.5mol/L(填“大于”、“小于”或“等于”)。
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀 |
B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
A.AB.BC.CD.D

