题目内容
【题目】加热N2O5,依次发生的分解反应:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
【答案】B
【解析】试题分析:设分解的N2O3物质的量为x mol,反应过程中共生成N2O3(x+3.4)mol,在反应①中N2O5分解了(x+3.4)mol,同时生成O2(x+3.4)mol。在反应②中生成氧气xmol,则(x+3.4)+x=9,求得x=2.8。所以平衡后N2O5、N2O3、O2浓度依次为c(N2O5)=(8-2.8-3.4)÷2=0.9molL-1;c(N2O3)=3.4÷2=1.7molL-1;c(O2)=9÷2=4.5molL-1。则T℃时![]() =
=![]() =8.5,故选B。
=8.5,故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
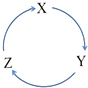
【题目】下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | X | Y | Z |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A.A
B.B
C.C
D.D
