题目内容
【题目】化学平衡是最重要的化学反应原理之一。
(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)![]() C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有__(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是___(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=__。
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g)![]() CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为___L。
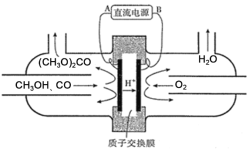
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为___(填“A”或“B”),写出阳极的电极反应式___。
【答案】BD AC 1.25 KA=KB>KC 1.6 A 2CH3OH+CO-2e-=(CH3O)2CO+2H+
【解析】
(1)②根据等效平衡原理:恒温恒容条件下反应前后体积改变的反应,通过化学计量数比换算成同一半边的物质后,物质的量与原平衡相等即等效,可知开始时加入1molC与原平衡等效,平衡时对应各组分的物质的量相等,则可知Q1、Q2和q的关系,据此分析。
③分析题给信息,温度不变,则平衡常数不变,根据原平衡可计算出平衡常数,根据平衡常数的计算式,进而可计算出a的值。
(1)①分析题给信息,根据化学平衡的特点,正逆反应速率相等或变量不变即可说明反应达平衡状态:
A.消耗0.1molA的同时生成0.1molC指的都是正反应速率,不能说明反应达到平衡状态,A项错误;
B.由反应方程式可知,该可逆反应为反应前后气体分子数减小的反应,故容器中气体的压强不随时间而变化,即总压强一定,说明该反应达平衡状态,B项正确;
C.根据题给信息,恒容条件下,该反应中物质的总质量不变,任何时刻容器中气体密度都不随时间而变化,故不能说明该反应达平衡状态,C项错误;
D.根据题给信息:向容积为1L的恒温恒容密闭容器中加入1molA气体和1molB气体后发生反应,ts后,反应达到平衡状态,生成0.5molC气体,则根据反应方程式可知,消耗0.5molA气体,则A气体的转化率=![]() ,则A的转化率为50%可以说明反应达平衡状态,D项正确;
,则A的转化率为50%可以说明反应达平衡状态,D项正确;
答案选BD。
②根据等效平衡可知,保持容器温度和容积不变,开始时向容器中加入1molC气体与开始时加入1molA气体和1molB气体是等效的,则有:Q1+Q2=q,据此可知,Q1+2Q2>q。故AC正确;
答案选AC。
③原平衡中,加入1molA气体和1molB气体,达平衡后生成0.5molC气体,则根据反应方程式可知,平衡时A、B气体的物质的量均为0.5mol,则平衡常数K=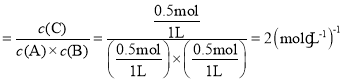 。
。
在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则可知重新达平衡时,B又消耗了![]() ,由题意可知,温度不变,平衡常数不变,根据三段式,有:
,由题意可知,温度不变,平衡常数不变,根据三段式,有:

则平衡常数K= ,解得a=1.25,答案为:1.25;
,解得a=1.25,答案为:1.25;
(2)①分析题中转化率-温度图可知,随着温度升高,CO的转化率逐渐降低,说明升高温度,平衡向逆反应方向移动,该可逆反应为放热反应。根据平衡常数只与温度有关,A点和B点的温度相同,则KA=KB。A、B点温度为T1℃,C点温度为T2℃,T2℃>T1℃,该可逆反应正反应为放热反应,故KA=KB>KC。答案为:KA=KB>KC;
②由题可知,A点时CO的转化率为0.5,则CO转化的物质的量=![]() ,容器体积为8L,则有:
,容器体积为8L,则有:

平衡常数K=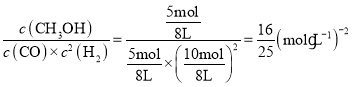
A点和B点的温度相同,平衡常数K也相同。B点时CO的转化率为0.8,则CO转化的物质的量=![]() 。设平衡状态B时容器的体积为V,则据题意有:
。设平衡状态B时容器的体积为V,则据题意有:

平衡常数K=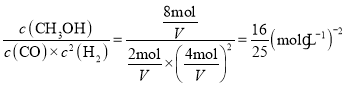 ,解得:V=1.6L。答案为:1.6;
,解得:V=1.6L。答案为:1.6;
(3)由题中所给工作原理图,可知该装置为电解池。由图可知,H+向右侧移动,根据电解池原理,阳离子移向阴极,阴极与电源的负极相连,由此可知,B为电源的负极,电源的正极为A。阳极发生氧化反应,结合电解池的工作原理图,可知,阳极的电极反应方程式为:2CH3OH+CO-2e=(CH3O)2CO+2H+;答案为:A;2CH3OH+CO-2e-=(CH3O)2CO+2H+。