题目内容
【题目】常温下,用0.10mol·L-1的AgNO3溶液分别滴定体积均为50.0mL的由Cl-与Br-组成的混合溶液和由C1-与I-组成的混合溶液(两混合溶液中Cl-浓度相同,Br-与I-的浓度也相同),其滴定曲线如图所示。已知25℃时:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=4.9×10-13,Ksp(AgI)=8.5×10-16。
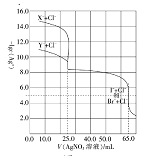
下列有关描述正确的是( )
A.图中X-为Br-
B.混合溶液中n(Cl-):n(I-)=8:5
C.滴定过程中首先沉淀的是AgCl
D.当滴入AgNO3溶液25mL时,Cl-与Br-组成的混合溶液中c(Ag+)=7×10-7mol·L-1
【答案】B
【解析】
向体积均为50.0mL的由Cl-与Br-组成的混合溶液和由Cl-与I-组成的混合溶液中滴加0.10mol·L-1的AgNO3溶液,根据溶度积数据,Cl-与I-组成的混合溶液中I-先沉淀,Cl-与组成的混合溶液中Br-先沉淀,由图象可知当加入25mLAgNO3溶液时I-和Br-分别反应完,当加入65mLAgNO3溶液时Cl-反应完,据此分析解答。
A、由于Ksp(AgBr)>Ksp(AgI),因此当开始沉淀时,I-浓度应该更小,纵坐标值应该更大,故X-表示I-;故A错误;
B、由图象可知,当滴定Cl-与I-组成的混合溶液时,当加入25mLAgNO3溶液时I-反应完,
n(I-)=0.025L![]() 0.10mol·L-1=0.0025mol;当加入65mLAgNO3溶液时Cl-反应完,即Cl-反应完消耗了40mLAgNO3溶液,n(Cl-)=0.04L
0.10mol·L-1=0.0025mol;当加入65mLAgNO3溶液时Cl-反应完,即Cl-反应完消耗了40mLAgNO3溶液,n(Cl-)=0.04L![]() 0.10mol·L-1=0.004mol,混合溶液中n(Cl-):n(I-)=0.004mol:0.0025mol=8:5,故B正确;
0.10mol·L-1=0.004mol,混合溶液中n(Cl-):n(I-)=0.004mol:0.0025mol=8:5,故B正确;
C、由溶度积可知,滴定过程中首先沉淀的是AgI,故C错误;
D、由图象可知,当滴入AgNO3溶液25mL时,Cl-与Br-组成的混合溶液中c(Ag+)<7×10-7mol·L-1,故D错误。
答案选B。

【题目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是两种重要的化工原料。
,是两种重要的化工原料。
(1)实验室制备![]() 的装置图(如图)和有关信息如下:
的装置图(如图)和有关信息如下:

物质 | 熔点/℃ | 沸点/℃ | 密度 | 性质 |
白磷 | 44.1 | 280.5 | 1.82 | 湿空气中约40℃着火 |
|
| 74.2 | 1.574 | 无色液体,遇水均剧烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①实验开始先打开![]() 通入
通入![]() 排除装置内空气的目的是______________________。
排除装置内空气的目的是______________________。
②实验制得的粗产品中含有![]() ,可用_______方法提纯。
,可用_______方法提纯。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他离子的浓度由大到小的顺序是___________________________________(已知
之外其他离子的浓度由大到小的顺序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)实验室通常用![]() 直接氧化
直接氧化![]() 制备
制备![]() ,工业上通常采用潮湿的
,工业上通常采用潮湿的![]() 氧化
氧化![]() 制备
制备![]() ,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
(3)用![]() 标准溶液定量测定实验室制备的
标准溶液定量测定实验室制备的![]() 粗产品的纯度,实验步骤如下:
粗产品的纯度,实验步骤如下:
①取![]() 粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入
粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入![]() 溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的
溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的![]() 纯度___________(填“偏大”“偏小”或“不变”)。[已知:
纯度___________(填“偏大”“偏小”或“不变”)。[已知:![]() ]
]
②滴加![]() 作指示剂,用
作指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 溶液,当溶液__________________________,即为终点。共用去
溶液,当溶液__________________________,即为终点。共用去![]() 溶液,则粗产品中
溶液,则粗产品中![]() 的纯度为_________%(保留小数点后1位)。
的纯度为_________%(保留小数点后1位)。