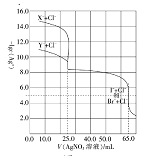
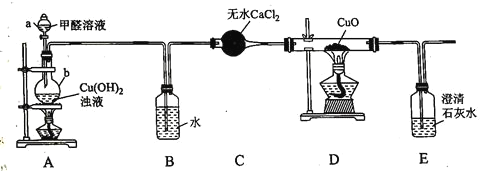
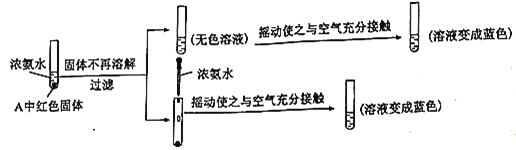
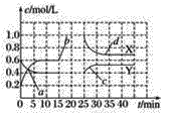
题目内容
【题目】下列叙述正确的是( )
A.不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半
B.5.6g铁与足量稀硫酸反应失去的电子的物质的量为0.2mol
C.标准状况下,11.2LNO2气体中含氧原子数大于18g水中含有的氧原子数
D.20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol/L
【答案】B
【解析】
A.硫酸溶液密度大于1,所以等体积混合得到溶液浓度大于平均值,不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度比原来的一半大,故A错误;
B.5.6g铁与足量稀硫酸反应生成亚铁离子,失去的电子的物质的量为![]() ×2=0.2mol,故B正确;
×2=0.2mol,故B正确;
C.标准状况下,11.2LNO2气体中含氧原子数为![]() ×2=1mol,18g水中含有的氧原子数为
×2=1mol,18g水中含有的氧原子数为![]() ×1=1mol,两者相等,故C错误;
×1=1mol,两者相等,故C错误;
D.20gNaOH溶于1L水,溶液的体积不是1L,故D错误;
故答案为:B。

练习册系列答案
相关题目