题目内容
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_____________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
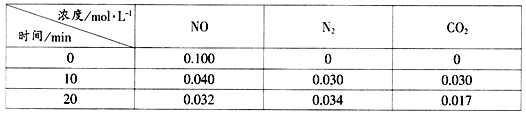
①T℃时,该反应的平衡常数为__________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
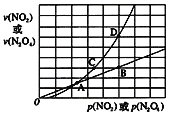
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_______;在上图标出点中,指出能表示反应未达到平衡状态的点是_________。
【答案】2NO(g)═N2O2(g) △H=(E3E4)kJ/mol 反应Ⅱ 温度升高后反应I平衡逆向移动,导致N2O4浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢 0.56 分离出了二氧化碳(减小CO2的浓度) > 2k2Kp A、C
【解析】
(1)①根据能量关系图,反应①为NO转化为N2O2,反应物能量高于生成物能量,所以反应①为放热反应,△H=( E3E4)kJ/mol;
②反应活化能越大,反应速率越慢,对该反应体系升高温度,发现总反应速率反而变慢,根据两步反应的速率分析;
(2)①平衡时,各物质的物质的量不变,则该反应达到平衡状态,K=![]() ;
;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质;
③根据Qc与K的关系分析;
(3)反应达到平衡时v正=v逆,满足平衡条件v(NO2)=2v (N2O4)即为平衡点,反之则为未平衡点。
(1)①根据能量关系图,反应①的为放热反应,反应为:2NO(g)═N2O2(g) △H=(E3E4)kJ/mol;故答案为:2NO(g)═N2O2(g) △H=(E3E4)kJ/mol;
②反应活化能越大,反应速率越慢,化学反应速率由最慢的一步决定,所以决定2NO(g)+O2(g)2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,两步反应过程均为放热过程,温度升高后反应I平衡逆向移动,导致N2O4浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O4浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢;
(2)①平衡时,各物质的物质的量不变,则该反应达到平衡状态,K=![]() =
=![]() =0.56;故答案为:0.56;
=0.56;故答案为:0.56;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质(减小CO2的浓度):故答案为:分离出了二氧化碳(减小CO2的浓度);
③原先达到平衡时,Qc=K,在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,Qc'=![]() =
=![]() Qc<K,所以反应正向进行,v正>v逆;故答案为:>;
Qc<K,所以反应正向进行,v正>v逆;故答案为:>;
(3)反应达到平衡时v正=v逆,v正=k1p2(NO2),v逆=2k2p(N2O4),所以Kp=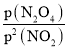 =
=![]() ,所以k1=2k2Kp,满足平衡条件v(NO2)=2v(N2O4)即为平衡点,根据图象,B、D所对应的速率刚好为1:2的关系,所以B、D为平衡点,A、C为未达到平衡状态的点;故答案为:2k2Kp;A、C。
,所以k1=2k2Kp,满足平衡条件v(NO2)=2v(N2O4)即为平衡点,根据图象,B、D所对应的速率刚好为1:2的关系,所以B、D为平衡点,A、C为未达到平衡状态的点;故答案为:2k2Kp;A、C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案