题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2 )在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
ii. CO2(g)+ H2(g)![]() CO(g)+ H2O(g) H2=+41 kJ·mol- 1
CO(g)+ H2O(g) H2=+41 kJ·mol- 1
iii. CO(g)+2H2(g)![]() CH3OH(g) H3=-99 kJ·mol- 1
CH3OH(g) H3=-99 kJ·mol- 1
回答下列问题:
(1)Q=______________
(2)反应iii的化学平衡常数K3=_____________(填表达式)。
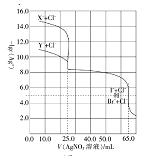
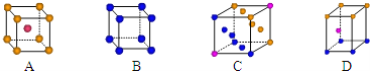
(3)图中能正确反映平衡常数K3随温度变化关系的曲线为_____(填字母),理由是_______

(4)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。
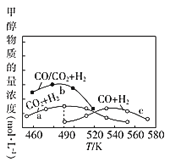
①490K时,根据曲线a、c判断合成甲醇时主要发生的反应为______________(填"i ”或" iii");由曲线a可知,甲醇的量先增大后减小,其原因是__________。
②曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ii分析原因:__________。
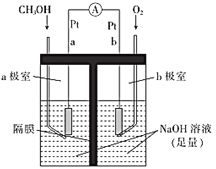
(5)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为__________, 若隔膜为阳离子交换膜,则每转移6 mol电子,溶液中有___mol Na+向___(填“正极区”或“负极区”)移动。
【答案】-58 ![]() a 反应iii的H3<0,为放热反应,温度升高平衡左移,平衡常数减小 i 温度低于490K时单位时间内反应未达到平衡,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移 加入CO促进反应ii平衡逆向移动,CO2和H2的量增加,甲醇生成速率加快,同时反应ii为吸热反应,反应i为放热反应,反应ii的存在使得反应i正向进行 CH3OH+8OH--6e-===CO3-+6H2O 6 正极
a 反应iii的H3<0,为放热反应,温度升高平衡左移,平衡常数减小 i 温度低于490K时单位时间内反应未达到平衡,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移 加入CO促进反应ii平衡逆向移动,CO2和H2的量增加,甲醇生成速率加快,同时反应ii为吸热反应,反应i为放热反应,反应ii的存在使得反应i正向进行 CH3OH+8OH--6e-===CO3-+6H2O 6 正极
【解析】
(1)根据定律进行分析得出CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g)H1= H2+ H3,据此进行计算;
CH3OH(g)+ H2O(g)H1= H2+ H3,据此进行计算;
(2)根据平衡常数的定义写出反应iii的平衡常数K3=![]() ;
;
(3)根据温度对平衡移动的影响进行分析;
(4)①据图可知490K时主要发生反应i;温度低于490K时单位时间内反应未达到平衡,温度高于490K时单位时间内反应达到平衡,据此规律进行分析;
②根据浓度对平衡移动的规律进行分析;
(5)该装置是以NaOH溶液为电解质溶液的甲醇燃料电池,电极a为负极,甲醇失电子被氧化成二氧化碳,由于为碱性电解质溶液,二氧化碳被吸收生成碳酸根,据此写出电极方程式;原电池中阳离子流向正极,为保持电荷守恒,满足n(e-)=n(Na+)。
(1)已知:ii. CO2(g)+ H2(g)![]() CO(g)+ H2O(g) H2=+41 kJ·mol- 1
CO(g)+ H2O(g) H2=+41 kJ·mol- 1
iii. CO(g)+2H2(g)![]() CH3OH(g) H3=-99 kJ·mol- 1
CH3OH(g) H3=-99 kJ·mol- 1
根据盖斯定律由ii+ iii可得i. CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g),所以H1= H2+ H3,所以Q=+41 kJ·mol- 1+(-99 kJ·mol- 1)=-58 kJ·mol- 1;
CH3OH(g)+ H2O(g),所以H1= H2+ H3,所以Q=+41 kJ·mol- 1+(-99 kJ·mol- 1)=-58 kJ·mol- 1;
(2)根据平衡常数的定义可知反应iii的平衡常数K3=![]() ;
;
(3)反应iii的H3<0,为放热反应,温度升高平衡左移,平衡常数减小,所以曲线a能正确反映平衡常数K3随温度变化关系;
(4)①据图可知490K时主要发生反应i;温度低于490K时单位时间内反应未达到平衡,温度升高反应速率加快,单位时间内测得的甲醇含量增大,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,导致甲醇含量降低;
②加入CO促进反应ii平衡逆向移动,CO2和H2的量增加,甲醇生成速率加快,同时反应ii为吸热反应,反应i为放热反应,反应ii的存在使得反应i正向进行;
(5)该装置是以NaOH溶液为电解质溶液的甲醇燃料电池,电极a为负极,甲醇失电子被氧化成二氧化碳,由于为碱性电解质溶液,二氧化碳被吸收生成碳酸根,所以电极方程式为:CH3OH+8OH--6e-===CO3-+6H2O;原电池中阳离子流向正极,为保持电荷守恒每转移6 mol电子,溶液中有6mol Na+向正极区移动。