题目内容
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
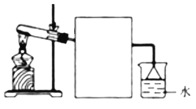
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
【答案】NaHCO3===Na++HCO3— OH—+ HCO3-=CO32—+H2O Fe3+ NH4++OH-![]() NH3↑+ H2O NH4+、Na+、CO32- 取少量原溶液于试管中,先加足量稀硝酸,再滴加AgNO3溶液,若有白色沉淀生成,则存在Cl- NH4++2OH-+2O2=NO3-+3H2O 5mol
NH3↑+ H2O NH4+、Na+、CO32- 取少量原溶液于试管中,先加足量稀硝酸,再滴加AgNO3溶液,若有白色沉淀生成,则存在Cl- NH4++2OH-+2O2=NO3-+3H2O 5mol
【解析】
(1)碳酸氢钠是强电解质完全电离生成钠离子和碳酸根离子;NaOH和NaHCO3反应生成碳酸根和水;
(2)①无色透明溶液中不会有Fe3+;
②加入过量氢氧化钠浓溶液并加热,生成气体,说明存在NH4+;
③根据电荷守恒和原子守恒分析;
②根据电子得失守恒计算。
(1)碳酸氢钠是强电解质完全电离生成钠离子和碳酸根离子,电离方程式为NaHCO3=Na++HCO3-;NaOH和NaHCO3反应生成碳酸根和水,离子方程式为:OH-+ HCO3-=CO32-+H2O;
(2)①Fe3+有颜色,无色透明溶液中不会有Fe3+,故根据溶液颜色可以判断溶液中不存在的离子是Fe3+;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体,说明存在NH4+,离子方程式为:NH4++OH-![]() NH3↑+ H2O;
NH3↑+ H2O;
③取其中的一份进行实验,加448入过量氢氧化钠溶液并加热,生成气体44mL气体即为氨气,n(NH3)=![]() =0.02mol,一定含有0.02mol NH4+,浓度是0.02mol÷0.1L=0.2mol/L;取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀3.94g,过滤,向沉淀中再加入过量稀盐酸,沉淀全部消失,则一定含有CO32-,所以一定不存在Ba2+、SO42-;其中碳酸钡是3.94g,物质的量是0.02mol,碳酸根的物质的量是0.02mol,浓度是0.02mol÷0.1L=0.2mol/L;根据电荷守恒可知溶液中必定还存在Na+,不能确定是否存在氯离子;检验氯离子可以取少量原溶液于试管中,先加足量稀硝酸,再滴加AgNO3溶液,若有白色沉淀生成,则存在Cl-;
=0.02mol,一定含有0.02mol NH4+,浓度是0.02mol÷0.1L=0.2mol/L;取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀3.94g,过滤,向沉淀中再加入过量稀盐酸,沉淀全部消失,则一定含有CO32-,所以一定不存在Ba2+、SO42-;其中碳酸钡是3.94g,物质的量是0.02mol,碳酸根的物质的量是0.02mol,浓度是0.02mol÷0.1L=0.2mol/L;根据电荷守恒可知溶液中必定还存在Na+,不能确定是否存在氯离子;检验氯离子可以取少量原溶液于试管中,先加足量稀硝酸,再滴加AgNO3溶液,若有白色沉淀生成,则存在Cl-;
(3)①NH4+被氧气(O2)氧化成NO3-,同时氧气被还原成水,该反应的离子方程式为:NH4++2OH-+2O2=NO3-+3H2O;
②HNO3完全转化成N2,N元素得到5个电子由+5价下降到0价,6molHNO3完全转化得到30mol电子;反硝化过程中甲醇(C元素为-2价)转化为CO2,C元素失去6个电子由-2价上升到+4价,根据得失电子守恒消耗的甲醇的物质的量为![]() =5mol。
=5mol。

 阅读快车系列答案
阅读快车系列答案