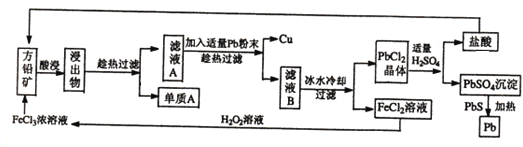
题目内容
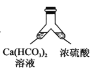
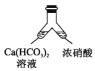
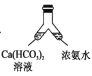
【题目】某化学兴趣小组为了制取并探究氨气的性质,按下图装置进行实验,制取氨气的原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
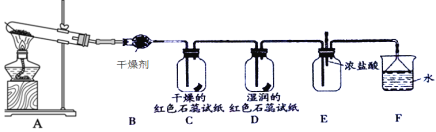
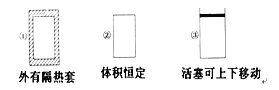
A.装置B中的干燥剂可以是P2O5B.装置C中的试纸不变色,D中试纸变蓝色
C.在装置E中滴入几滴浓盐酸会出现白烟D.装置F中的漏斗能起防倒吸作用
【答案】A
【解析】
A. 氨气为碱性气体,应选择碱性干燥剂碱石灰,不能用P2O5,故A错误;
B. 氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,C中的试纸不变色,故B正确;
C. 装置E中因有多余的氨气,当滴入几滴浓盐酸时会生成氯化铵晶体,产生白烟,故C正确;
D. 因为氨气极易溶于水,所以F中吸收氨气时用倒扣漏斗来防倒吸,故D正确;
题目要求选不正确的,故选A。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目