题目内容
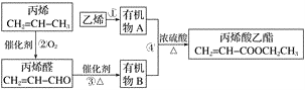
【题目】.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及他物质已经略去);![]()
Ⅰ. 若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为__________________________,体现B的_____________(选填 “氧化性”“还原性”“漂白性”)
(2)98%的浓硫酸改为氧化物形式SO3·nH2O,则n值为_________(可写成分数形式)
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出写出A→B的化学方程式_____________________________________________。
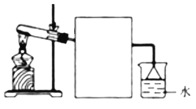
(2)实验室常用右图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图________。
(3)尾气处理装置中使用倒扣漏斗的作用是________________________。
【答案】紫色溶液褪色 还原性 ![]() 4NH3+5O2
4NH3+5O2 4NO+6H2O
4NO+6H2O ![]() 防止倒吸
防止倒吸
【解析】
Ⅰ.常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸。
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,应为NH3,则B为NO,C为NO2,D为HNO3。
Ⅰ. (1)SO2有还原性会被高锰酸钾氧化,将SO2通入KMnO4溶液的现象为:紫色溶液褪色;体现SO2的还原性;
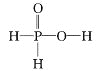
(2)设98%的浓硫酸质量为100g,则m(H2SO4)=100g×98%=98g,m(H2O)=100g-98g=2g,则n(H2SO4)=![]() =1mol,n(H2O)=
=1mol,n(H2O)= ![]() =
= ![]() mol,100g98%的浓硫酸中1mol硫酸分子等价1molSO3和1molH2O,水的总物质的量为
mol,100g98%的浓硫酸中1mol硫酸分子等价1molSO3和1molH2O,水的总物质的量为![]() mol+1mol=
mol+1mol=![]() ,改写为氧化物形式SO3·nH2O,则n=
,改写为氧化物形式SO3·nH2O,则n=![]() ;
;
Ⅱ.(1)由分析可知A为 NH3,B为NO,氨气的催化氧化可以生成NO,方程式为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)氨气密度比空气小,极易溶于水,不能用排水法收集,可以用向下排空气法收集,装置为![]()
(3) 尾气处理装置中使用倒扣漏斗的作用是:防止倒吸。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案