题目内容
【题目】某课外实验小组设计的下列实验合理的是


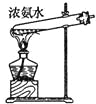
A. 配置一定浓度的硫酸 B. 制备少量氨气
C. 制备并收集少量NO2气体 D. 制备少量氧气,并随关随停
【答案】B
【解析】试题分析:A、浓硫酸在烧杯中稀释,A错误;B、浓氨水和氧化钙混合可以制备少量氨气,B正确;C、NO2不能用排水法收集,C错误;D、过氧化钠不是难溶于水的块状固体,不能用简易启普发生器,D错误,答案选B。
方法 | 化学方程式(或原理) | 气体发生装置 |
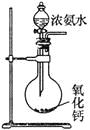
加热浓氨水 | NH3·H2O |
|
浓氨水+固体NaOH | NaOH溶于水放热,促使氨水分解,且OH-浓度的增大 |
|
浓氨水+固体CaO | CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO=NH3↑+Ca(OH)2 |

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2可用于生产甲醇,已知:2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1_______X2(填“>”或“<”,后同),Q_______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
③TK时,在该容积可变的恒压密闭容器中发生上述反应,测得有关数据如下表所示:
物质的量(mol) 时间(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
已知在10min时只改变了一个反应条件,用改变的条件可能是______。
④下列情况下能表明该反应达到平衡状态的是_____。
a.气体密度不变 b.混合气休的平均摩尔质量不变 c.消耗速率:2v(H2O)=v(CO2)
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
① 若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=______ [常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)