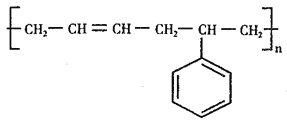
题目内容
【题目】按要求对图中两极进行必要的连接并填空:
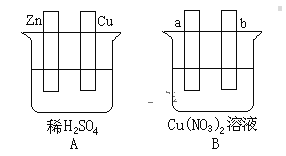
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫____。电极反应式:锌板:____;铜板:_____。
(2)在B图中,使a极析出铜,b极析出氧气。加以必要的连接后,该装置叫____。电极反应式,a极:____;b极:_____。经过一段时间后,停止反应,溶液的pH值____(升高、降低、不变),加入一定量的____后,溶液能恢复至与电解前完全一致。
【答案】原电池 Zn-2e-=Zn2+ 2H++2e-=H2↑ 电解池 Cu2++2e-=Cu 2H2O-4e-= O2↑+4H+(或4OH--4e-=2H2O+O2↑) 降低 CuO或CuCO3
【解析】
(1)在A图中,使铜片上冒H2气泡,则铜片作正极,锌作负极,该电池属于原电池,锌电极上失电子发生氧化反应,铜电极上氢离子得电子发生还原反应;
(2)在B图中,使a极析出铜,b极析出氧气,必须是电解池,a极为阴极,阴极上铜离子得电子发生还原反应,b极(惰性电极)为阳极,阳极上水电离出的氢氧根离子失电子发生氧化反应,根据电池总反应式确定溶液中氢离子浓度的变化,根据“析出什么加入什么”的原则加入物质,使溶液恢复至与电解前完全一致。
(1)在A图中,使铜片上冒H2气泡,可以用导线连接两极,铜片作正极,锌作负极,该电池属于原电池,锌电极上失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,铜电极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:原电池;Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)在B图中,使a极析出铜,b极析出氧气,必须是电解池,a极为阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu;b极(惰性电极)为阳极,阳极上水电离出的氢氧根离子失电子发生氧化反应,电极反应式为:2H2O-4e-= O2↑+4H+(或4OH--4e-=2H2O+O2↑);总反应的离子方程式为:2Cu2++2H2O![]() O2↑+4H+ +2Cu,由于生成硝酸,则经过一段时间后,停止反应,溶液的pH值降低,电解过程中,阴极上析出铜,阳极上析出氧气,且氧元素和铜元素物质的量之比为1:1,相当于析出CuO,根据“析出什么加入什么”的原则加入物质,要使溶液能恢复原来状态应该加入CuO或CuCO3(相当于CuOCO2),故答案为:电解池;Cu2++2e-=Cu;2H2O-4e-= O2↑+4H+(或4OH--4e-=2H2O+O2↑);降低;CuO或CuCO3。
O2↑+4H+ +2Cu,由于生成硝酸,则经过一段时间后,停止反应,溶液的pH值降低,电解过程中,阴极上析出铜,阳极上析出氧气,且氧元素和铜元素物质的量之比为1:1,相当于析出CuO,根据“析出什么加入什么”的原则加入物质,要使溶液能恢复原来状态应该加入CuO或CuCO3(相当于CuOCO2),故答案为:电解池;Cu2++2e-=Cu;2H2O-4e-= O2↑+4H+(或4OH--4e-=2H2O+O2↑);降低;CuO或CuCO3。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol