题目内容
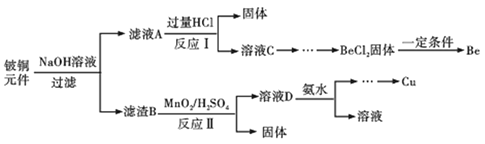
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
【答案】CuS、FeS Na2BeO2+4HCl=BeCl2+2NaCl+2H2O ![]() 生成NO2污染空气 在氯化氢气流下蒸发结晶 Fe3+ 4 80%
生成NO2污染空气 在氯化氢气流下蒸发结晶 Fe3+ 4 80%
【解析】
废旧铍铜元件(含BeO25%、CuS71%、少量和FeSSiO2),加入氢氧化钠溶液反应后过滤,信息可知BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠溶液反应,二氧化硅属于酸性氧化物,和氢氧化钠溶液反应生成硅酸钠和水,因此滤液A成分是NaOH、Na2SiO3、Na2BeO2,滤渣B为CuS、FeS,滤液中加入过量盐酸过滤得到固体为硅酸,溶液中为BeCl2,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤洗涤,再加入适量的HCl生成BeCl2,在HCl气氛中对BeCl2溶液蒸发结晶得到晶体,滤渣B中加入硫酸酸化的二氧化锰,MnO2能将金属硫化物中的硫元素氧化为单质硫,酸性介质中二氧化锰被还原为锰盐,过滤得到溶液D为硫酸铜、硫酸铁、硫酸锰的混合溶液,逐滴加入稀氨水调节pH可依次分离,最后得到金属铜,以此解答该题。
(1)由以上分析可知滤渣B为CuS、FeS;
(2)信息1得到BeO22-与过量盐酸反应的化学方程式为:Na2BeO2+4HCl=BeCl2+2NaCl+2H2O;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,酸性介质中二氧化锰被还原为锰盐,反应Ⅱ中Cu2S发生反应的离子方程式为:MnO2+CuS+4H+=S+Mn2++Cu2++2H2O;浓硝酸具有氧化性做氧化剂被还原为二氧化氮、NO2气体有毒污染环境;
(4)为了抑制Be2+离子的水解,需要在HCl气氛中对BeCl2溶液蒸发结晶;
(5)三种金属阳离子出现沉淀,结合浓度商与Ksp的关系,铜离子转化为沉淀c(OH-)=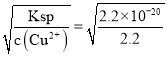 mol/L=1×10-10mol/L,Fe3+离子转化为沉淀,c(OH-)=
mol/L=1×10-10mol/L,Fe3+离子转化为沉淀,c(OH-)=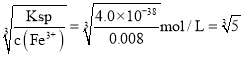 ×10-12mol/L,锰离子沉淀时,c(OH-)=
×10-12mol/L,锰离子沉淀时,c(OH-)=![]() ×10-5.5mol/L,因此首先沉淀的是Fe3+,为使铜离子沉淀c(H+)=
×10-5.5mol/L,因此首先沉淀的是Fe3+,为使铜离子沉淀c(H+)=![]() mol/L=10-4mol/L,pH=4,常温下应调节溶液的pH值大于4;
mol/L=10-4mol/L,pH=4,常温下应调节溶液的pH值大于4;
(6)混合物中BeO质量=1000×25%=250g,理论上得到Be的物质的量=![]() =10mol,实际得到Be物质的量=
=10mol,实际得到Be物质的量=![]() =8mol,产率=
=8mol,产率=![]() ×100%=80%。
×100%=80%。