题目内容
【题目】钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。KClO4中氯元素的化合价是_________,具有_________(填“还原性”或“氧化性”);Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做_________(填“还原剂”或“氧化剂”)。
(2)甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe粉和稀H2SO4 , B管中是NaOH溶液,请回答下列问题:
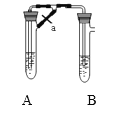
①同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是____________写出B中发生反应的所有离子方程式:___________________
②同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是__________ ;
③同学乙打开a的目的______________,根据以上实验判断___________(填甲或乙)同学可成功。
【答案】+7 氧化性 还原剂 生成灰白色沉淀迅速变成灰绿色,最后变成红褐色 Fe+2H+=Fe2++H2↑、Fe2++2OH-=Fe(OH)2↓ 有白色沉淀生成 使A管中产生的气体通入B管中赶走空气 乙
【解析】
(1)KClO4中氯元素的化合价为+7价,具有氧化性;反应6Na + Fe2O3 =3Na2O + 2Fe中Na元素化合价升高;
(2)①Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气导致溶液通过导管进入B装置,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3;
②生成的氢气将空气排出,发生反应:Fe2++2OH-=Fe(OH)2↓,能防止氢氧化亚铁被氧化;
③只要没有空气就能防止氢氧化亚铁被氧化,据此来回答。
(1)KClO4中氯元素的化合价为+7价,为最高价态,具有氧化性,反应6Na + Fe2O3 =3Na2O + 2Fe中Na元素化合价升高,被氧化,为还原剂;
(2)①A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入B试管,B中反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3,所以看到的现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,整个过程中涉及反应的离子方程式有Fe+2H+=Fe2++H2↑、Fe2++2OH-=Fe(OH)2↓;
②先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是:有白色沉淀生成(且不变色);
③通过以上分析知,乙同学的实验:先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,这样A中生成的氢气将空气排出,可制取纯净的Fe(OH)2。

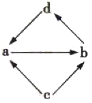
【题目】下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④