题目内容
【题目】实验室有一瓶淡黄色粉末,标签已脱落。某学习小组为确定其成分,进行实验探究。
(提出猜想)淡黄色粉末成分可能是
猜想一:硫黄
猜想二:过氧化钠
(实验步骤)
①按下图组装仪器;
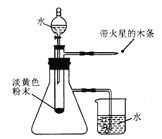
②………
③打开分液漏斗,滴加水;
④用带火星的木条靠近导气管的尖嘴处。
(实验现象)试管中剧烈反应,产生大量气泡;带火星的木条复燃;小烧杯中的导管口有气泡冒出;试管内最终得到无色溶液。
(结论与分析)
(1)实验步骤②迸行的操作是_______;(填字母代号)
A.先加入试剂,后检查装置气密性 B.先检查装置气密性,后加入试剂
(2)根据上述现象分析,猜想________正确;
(3)带火星的木条复燃,说明反应生成的气体是________;
(4)小烧杯中的导管口有气泡冒出,说明淡黄色粉末与水反应是_________(填“放热”或“吸热”)反应;
(5)淡黄色粉末与水反应的化学方程式为___________。
【答案】B 二 氧气 放热 2Na2O2+2H2O=4NaOH+O2↑
【解析】
由实验现象可知,该淡黄色固体为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,可使带火星的木条复燃。据此解答。
(1)先检查装置气密性,后加入试剂,如果先加入试剂,后检查装置气密性,会浪费药品,选B,故答案为:B;
(2)过氧化钠与水反应生成氢氧化钠和氧气,氧气具有助燃性,可以使带火星的木条复燃,则猜想二正确,故答案为:二;
(3)氧气具有助燃的性质,可使带火星的木条复燃,故答案为:氧气;
(4)小烧杯中的导管口有气泡冒出,说明淡黄色粉末与水的反应是放热反应,气体受热膨胀,故答案为:放热;
(5)过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑。

 阅读快车系列答案
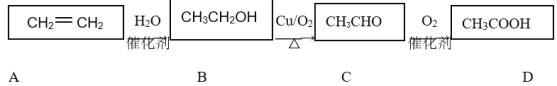
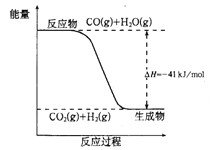
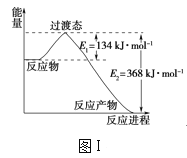
阅读快车系列答案【题目】(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为__。
(3)下表是部分化学键的键能数据:
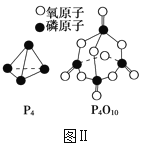
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | a | b | c | x |
已知1molP4(g)完全燃烧生成P4O10(g)放出的热量为dkJ,P4和P4O10的结构如图Ⅱ所示,则上表中x=___(用含有a、b、c、d的代数式表示)。