题目内容
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
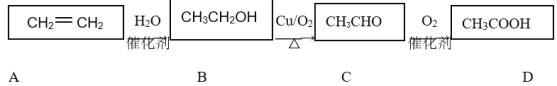
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
(3)完成B→C的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+__________。
2CH3CHO+__________。
【答案】羧基 A 2H2O
【解析】
由转化关系可知,不饱和烃乙烯一定条件下和水发生加成生成乙醇,乙醇在铜作催化剂作用下,和氧气共热发生氧化反应生成乙醛,乙醛在催化剂作用下,和氧气共热发生氧化反应生成乙酸。
(1)CH3COOH的官能团为羧基,故答案为:羧基;
(2)乙烯属于不饱和烃,分子中含有碳碳双键,既能与溴水发生加成反应使溴水褪色,又能与酸性高锰酸钾溶液发生氧化反应使酸性高锰酸钾溶液褪色,乙醇能与酸性高锰酸钾溶液发生氧化反应使酸性高锰酸钾溶液褪色,但不能使溴水褪色,故答案为:A;
(3)B→C的反应为乙醇在铜作催化剂作用下,和氧气共热发生氧化反应生成乙醛,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2H2O。
2CH3CHO+2H2O,故答案为:2H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目