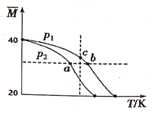
题目内容
【题目】A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为____。
(2)![]() 的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____;推测抗坏血酸在水中的溶解性:____(填“难溶于水”或“易溶于水”)。
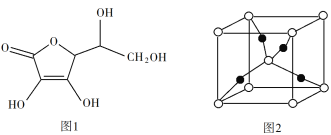
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____。
【答案】[Ar]3d9或1s22s22p63s23p63d9 正四面体 O sp3、sp2 易溶于水 4
【解析】
A.考查物质结构与性质,涉及内容为电子排布式的书写、空间构型、配合物知识、杂化类型的判断、溶解性等知识,都属于基础性知识,难度系数不大;
A.(1)本小题考查电子排布式的书写,Cu位于第四周期IB族,其价电子排布式为3d104s1,因此Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;
(2)本小题考查空间构型或配位原子,SO42-中S有4个σ键,孤电子对数为(6+2-2-4×2)/2=0,因此SO42-空间构型为正四面体形;[Cu(OH)4]2-中Cu2+提供空轨道,OH-提供孤电子对,OH-只有O有孤电子对,因此[Cu(OH)4]2-中的配位原子为O;
(3)考查杂化类型和溶解性,根据抗坏血酸的分子结构,该结构中有两种碳原子,单键的碳原子和双键的碳原子,单键碳原子以sp3杂化,双键的碳原子以sp2杂化;根据抗环血酸分子结构,其中含有-OH,能与水形成分子间氢键,增加在水中的溶解度,因此抗坏血酸易溶于水;
(4)考查晶胞的计算,白球位于顶点和内部,属于该晶胞的个数为8×1/8+1=2,黑球全部位于晶胞内部,属于该晶胞的个数为4,化学式为Cu2O,因此白球为O原子,黑球为Cu原子,即Cu原子的数目为4;