��Ŀ����
����Ŀ������AG��ʾ��Һ����ȣ�AG�Ķ���ΪAG=lg![]() ��������ʵ��������0.01 mol��L��1������������Һ�ζ�20.00 mL 0.01 mol��L-1���ᣬ�ζ�������ͼ��ʾ������������ȷ����
��������ʵ��������0.01 mol��L��1������������Һ�ζ�20.00 mL 0.01 mol��L-1���ᣬ�ζ�������ͼ��ʾ������������ȷ����
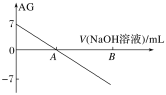
A.�����£�����ĵ��볣��ԼΪ10��5
B.A��ʱ��������������Һ�����Ϊ20.00 mL
C.��B��Ϊ40 mL��������Һ�У�c(Na+)=c(CH3COO-)+c(CH3COOH)
D.��A��B��ˮ�ĵ���̶����
���𰸡�A
��������
A.����ͼ���֪���������£�������Һ��AG=lg![]() =7����
=7����![]() =107����ˮ�����ӻ�Kw=c(H��)��c(OH-)=10-14����ʽ������֪��c(H��)=10��3..5 mol/L�����ڴ�����Һ�У�c(CH3COO-)��c(H��)=10��3.5 mol/L����˴���ĵ���ƽ�ⳣ��Ka=
=107����ˮ�����ӻ�Kw=c(H��)��c(OH-)=10-14����ʽ������֪��c(H��)=10��3..5 mol/L�����ڴ�����Һ�У�c(CH3COO-)��c(H��)=10��3.5 mol/L����˴���ĵ���ƽ�ⳣ��Ka=![]() ��
��![]() =10-5��A��ȷ��
=10-5��A��ȷ��
B.A���AG=lg![]() =0����
=0����![]() =1����c(H��)=c(OH-)����ʱ��Һ�����ԣ�������������������Һ20.00 mLʱ���������ƺʹ���ǡ����ȫ�кͣ��õ���������Һ����������ǿ�������Σ�CH3COO-ˮ��ʹ��Һ�Լ��ԣ�˵��A��ʱ��������������Һ�����С��20.00 mL��B����
=1����c(H��)=c(OH-)����ʱ��Һ�����ԣ�������������������Һ20.00 mLʱ���������ƺʹ���ǡ����ȫ�кͣ��õ���������Һ����������ǿ�������Σ�CH3COO-ˮ��ʹ��Һ�Լ��ԣ�˵��A��ʱ��������������Һ�����С��20.00 mL��B����
C.��B�����NaOH��Һ40 mLʱ��������ҺΪ��Ũ�ȵ�CH3COONa��NaOH�Ļ����Һ�����������غ��֪��c(Na+)=2[c(CH3COO-)+c(CH3COOH)]��C����
D.A��֮��V(NaOH)>20 mL��ˮ�ĵ����ܵ����ƣ�����̶��ֻ���С��D����
�ʺ���ѡ����A��