题目内容
【题目】根据溶解度和溶度积的相关知识,计算下列各题。
(1)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示]。
(2)已知25℃时BaSO4的溶度积Ksp=1.1×10-10,其溶解度为__________________。
(3)已知Ag2CrO4在298 K时的溶解度为0.00445 g,其溶度积为___________________。
【答案】![]() 2.4×10-4 g 9.62×10-12
2.4×10-4 g 9.62×10-12
【解析】
(1)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42=CaSO4+SO32,溶液中K=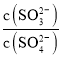 =
=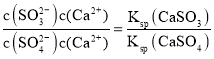 ,c(SO32-)=
,c(SO32-)=![]() ;
;
(2)根据BaSO4溶液中存在的沉淀溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq)可知,Ksp(BaSO4)=c(Ba2+)(SO42-),且c(Ba2+)=(SO42-),所以溶液中c(BaSO4)=(SO42-)=
Ba2+(aq)+SO42-(aq)可知,Ksp(BaSO4)=c(Ba2+)(SO42-),且c(Ba2+)=(SO42-),所以溶液中c(BaSO4)=(SO42-)=![]() =1.05×10-5molL-1,设溶液体积为100mL,m(BaSO4)=n×M= c(BaSO4)×V×M(BaSO4)=1.05×10-5molL-1×0.1L×233g/mol=2.4×10-4 g,100mL该溶液的质量约是100g,所以其溶解度是2.4×10-4 g;
=1.05×10-5molL-1,设溶液体积为100mL,m(BaSO4)=n×M= c(BaSO4)×V×M(BaSO4)=1.05×10-5molL-1×0.1L×233g/mol=2.4×10-4 g,100mL该溶液的质量约是100g,所以其溶解度是2.4×10-4 g;
(3)铬酸银(Ag2CrO4)饱和溶液是极稀的,其密度可认为是1g/mL,已知Ag2CrO4的相对分子质量为332,所以Ag2CrO4饱和溶液的物质的量浓度为:![]() =1.34×10-4mol/L,因Ag2CrO4(s)
=1.34×10-4mol/L,因Ag2CrO4(s)![]() 2Ag+(aq)+ CrO42-,所以c(Ag+)=2×1.34×10-4mol/L,c(CrO42-)=1.34×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+) c(CrO42-)=(2×1.34×10-4)2×1.34×10-4 =9.62×10-12。
2Ag+(aq)+ CrO42-,所以c(Ag+)=2×1.34×10-4mol/L,c(CrO42-)=1.34×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+) c(CrO42-)=(2×1.34×10-4)2×1.34×10-4 =9.62×10-12。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案