题目内容
13.工业上利用BaSO4制备BaCl2的工艺流程如下: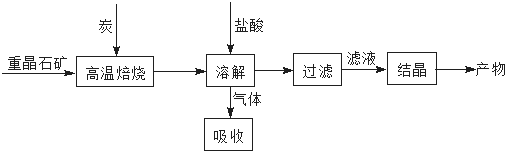
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S.Na2S水溶液显碱性的原因是S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-(用离子方程式表示).
(2)已知有关反应的热化学方程式如下:
BaSO4(s)+4C(s)$\stackrel{高温}{?}$4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g)$\stackrel{高温}{?}$2CO(g)△H2=+172.5kJ/mol
则反应BaSO4(s)+2C(s)$\stackrel{高温}{?}$ 2CO2(g)+BaS(s)△H3=+226.2kJ/mol
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4得到充分的还原(或提高BaS的产量),BaSO4与C反应为吸热反应,利用C和空气中的O2反应放热来维持反应所需的高温.
分析 本题以BaSO4制备BaCl2的工艺流程为载体,考查了利用盐类水解解释Na2S水溶液显碱性的原因、运用盖斯定律进行热化学反应的计算以及根据平衡移动的理论探究增加空气的量是为了促进反应正向进行,提高产量,据此可作答;
(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)利用盖斯定律计算;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行.
解答 解:(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)已知BaSO4(s)+4C(s )$\stackrel{高温}{?}$4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g)$\stackrel{高温}{?}$2CO(g)△H2=+172.5kJ/mol,
利用盖斯定律将①-2×②可得BaSO4(s)+2C(s)$\stackrel{高温}{?}$2CO2(g)+BaS(s)
△H3=(+571.2kJ/mol)-2×(+172.5kJ/mol)=+226.2kJ/mol,
故答案为:+226.2;
(3)加入过量碳有利于硫酸钡充分反应,题中反应均为吸热反应,所以生成需要提供能量才能完成,本生产可以借助过量的碳和氧气燃烧为生产提供能量,维持高温条件,故答案为:使BaSO4得到充分的还原(或提高BaS的产量);硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温.
点评 本题考查较为综合,涉及物质的制备方案的涉及以及电解原理等知识,注意电解中最关键的是准确判断出电极上离子的放电顺序.在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子.而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 二氧化硫与足量氢氧化钠溶液反应 SO2+2OHˉ=SO32-+H2O | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-═2A1O${\;}_{2}^{-}$+H2↑ |
| A. | 用钠制取钛:TiCl4+4Na=4NaCl+Ti该反应转移4e- | |
| B. | SO2+2H2S=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为2:3 | |
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,二氧化硅是氧化剂,C是还原剂 | |
| D. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2中,每生成1molHg反应转移4mole- |
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 福尔马林、水玻璃、氨水均为混合物 |
| A. | 弱酸的电离程度增大 | B. | 弱酸分子的浓度减小 | ||
| C. | 溶液的c(OH-)增大 | D. | 溶液的导电性增强 |
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯(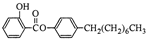 )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑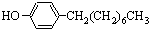 ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
.