题目内容
【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
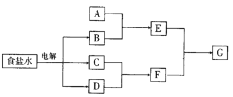
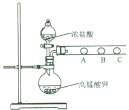
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。 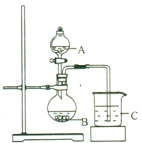
【答案】铝热反应得到熔融态的铁,此温度下铝也为熔融态,二者融合在一起形成铁铝合金 氢氧化钠溶液 2Al+2OH-+2H2O=2A1O2-+3H2 ![]() 不正确 2Fe3++Fe=3Fe2+或3Fe3++Al=A13++3Fe2+ 圆底烧瓶内充满黄绿色气体,A处由无色变橙黄色,B处变蓝,C处褪色 没有尾气处理装置,在C的右端塞入一团沾有浓NaOH溶液的棉花 不能 挥发出的硝酸可能使烧杯内出现浑浊
不正确 2Fe3++Fe=3Fe2+或3Fe3++Al=A13++3Fe2+ 圆底烧瓶内充满黄绿色气体,A处由无色变橙黄色,B处变蓝,C处褪色 没有尾气处理装置,在C的右端塞入一团沾有浓NaOH溶液的棉花 不能 挥发出的硝酸可能使烧杯内出现浑浊
【解析】
(1)①铝的熔点低于铁的熔点、但沸点高于Fe的熔点;
②根据铝与氢氧化钠溶液反应放出氢气设计实验;
③铁、Al能把Fe3+还原为Fe2+;
(2)烧瓶中浓盐酸与高锰酸钾能反应生成氯气;A处NaBr和氯气反应生成氯化钠和溴单质、B 处KI和氯气反应生成氯化钾和碘单质、C处湿润的氯气具有漂白性;氯气有毒,不能直接排放到空气中;
(3)由图所示的实验装置可知,根据强酸制取弱酸的反应比较非金属性,最高价氧化物的水化物酸性越强,对应非金属元素的非金属性越强;
(1)①铝热反应得到熔融态的铁,此温度下铝也可为熔融态,二者融合在一起形成铁铝合金,铝热反应所得到的熔融物应是铁铝合金;
②铝与氢氧化钠溶液反应放出氢气,把铝热反应所得的固体样品放入热氢氧化钠溶液中,若有气泡生成说明样品中含有金属铝,反应离子方程式是2Al+2OH-+2H2O=2A1O2-+3H2 ![]() ;
;
③熔融物中含有铁、Al,铁、Al能把Fe3+还原为Fe2+,将熔融物用酸完全溶解后加入KSCN,若溶液不变红,不能证明熔融物中一定不含Fe2O3,反应的离子方程式是2Fe3++Fe=3Fe2+或Al+3Fe3+=Al3++3Fe2+;
(2) 圆底烧瓶内浓盐酸与高锰酸钾能反应生成氯气,烧瓶中充满黄绿色气体, NaBr和氯气反应生成氯化钠和溴单质,A处蘸有NaBr溶液的棉花由无色变橙黄色;KI和氯气反应生成氯化钾和碘单质,碘遇淀粉变蓝色,所以B处湿润的淀粉KI试纸变蓝;湿润的氯气具有漂白性,所以C处湿润的红纸褪色;氯气有毒,不能直接排放到空气中,不足之处是没有尾气处理装置,改进方法是在C的右端塞入一团沾有浓NaOH溶液的棉花。
(3)较强的酸可以制备较弱的酸,而元素的非金属性越强,最高价氧化物的水化物的酸性就越强,所以可利用硝酸和碳酸钙反应生成CO2,将CO2通入到硅酸盐溶液中生成硅酸沉淀即可以完成实验,该装置存在缺陷是因为硝酸具有挥发性,挥发出的硝酸可能使烧杯内出现浑浊,干扰碳酸与硅酸酸性的比较。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案