题目内容
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的正极反应式为:___________,负极反应式为:_____________。
②请写出电解食盐水的化学方程式:____________________。
③电解后溶液的c(OH-)=________,理论上消耗二甲醚的质量为________(保留一位小数)。
【答案】-122.5 kJ·mol-1 3O2+12H++12e-=6H2O CH3OCH3+3H2O-12e-=2CO2+12H+ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 1 mol·L-1 0.8 g
2NaOH+H2↑+Cl2↑ 1 mol·L-1 0.8 g
【解析】
(1)首先写出反应的化学方程式,然后利用盖斯定律计算所需热化学方程式;
(2)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,正极是氧气得到电子在酸性溶液中生成水,结合电荷守恒和原子守恒书写电极反应;
②电极饱和食盐水生成氢氧化钠、氯气和氢气;
③根据电解氯化钠溶液的电解方程式来计算溶液中的OH-的物质的量,然后根据物质的量浓度与物质的量关系式计算溶液中c(OH-),结合电极反应和电子守恒计算消耗二甲醚的质量。
(1)利用盖斯定律进行计算,将三个方程式进行形式变换。
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
根据盖斯定律,①×2-2×②+③整理可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=-122.5 kJmol-1;
(2)①正极上是氧气得到电子发生还原反应,在酸性溶液中生成生成水,电极反应为:O2+4e-+4H+=2H2O,也可写为:3O2+12H++12e-=6H2O;在负极上二甲醚失去电子发生氧化反应,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②电极饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,同时溶液中生成氢氧化钠,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
③由方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑可知:之后反应为直接电解水,n(H2)=
2NaOH+H2↑+Cl2↑可知:之后反应为直接电解水,n(H2)=![]() =0.1mol,则根据方程式可知n(NaOH)=2n(H2)=0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=0.2mol÷0.2L=1mol/L;
=0.1mol,则根据方程式可知n(NaOH)=2n(H2)=0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=0.2mol÷0.2L=1mol/L;
电解过程中电子转移总数为0.2mol,结合电极反应和电子守恒计算CH3OCH3+3H2O-12e-=2CO2+12H+,消耗甲醚物质的量n(CH3OCH3)=![]() mol,其质量为m(CH3OCH3)=
mol,其质量为m(CH3OCH3)=![]() mol×46g/mol=0.8g。
mol×46g/mol=0.8g。

【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
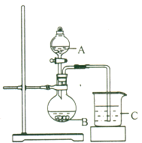
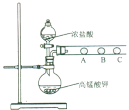
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
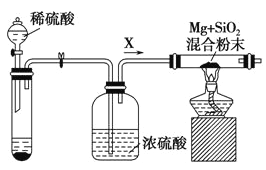
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。