题目内容
【题目】甲醇是一种常见的燃料,也是重要的基础化工原料。回答下列问题:
(1)采用甲醇气相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
则制备二甲胺反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定条件下,甲醇气相氨化法原料气中c(CH3OH):c(NH3)分别为1:1、2:1、3:1时,NH3的平衡转化率随温度变化的关系如图:
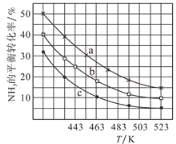
①代表原料气中c(CH3OH):c(NH3)=1:1的曲线是________。
②一定温度下,控制原料气中c(CH3OH):c(NH3)=3:1,能增大NH3平衡转化率的措施是_______。
③温度为443K时,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始浓度为2mol/L,则反应达到平衡时,(CH3)2NH的体积分数为_______,该温度下的化学平衡常数为________ 。
(3)甲醇可通过电化学方法由甲烷直接制得,装置如下图所示,电解生成CH3OH的过程分为3步:

①通电时,氯离子先转化为高活性的原子氯(Cl·);
②Cl·与吸附在电极上的CH4反应生成HCl和CH3Cl;
③在碱性电解液中,CH3Cl转化为目标产物CH3OH。
步骤①的电极反应式为__________,步骤③的离子方程式为__________,维持电流强度为1.5A,装置工作2小时,理论上可制得CH3OH的质量为________g。(已知F=96500C/mol,不考虑气体溶解等因素)
【答案】-1367 c 及时移去产物 8.3%或![]()
![]() 或0.037 Cl--e-= Cl· CH3Cl+OH-=CH3OH+Cl- 1.8
或0.037 Cl--e-= Cl· CH3Cl+OH-=CH3OH+Cl- 1.8
【解析】
(1)已知:
a.2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122 kJ/mol;
b.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol;
c.4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol;
根据盖斯定律a+![]() b-
b-![]() c可得反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g) 的H=-3122 kJ/mol+
c可得反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g) 的H=-3122 kJ/mol+![]() ×(-472 kJ/mol)-
×(-472 kJ/mol)-![]() ×(-7492 kJ/mol)= -1367 kJ/mol;
×(-7492 kJ/mol)= -1367 kJ/mol;
(2)①假设氨气的浓度不变,改变甲醇的浓度,则甲醇的浓度越大,相同条件下,氨气的转化率越高,所以题目所给三种投料比中,当c(CH3OH):c(NH3)为1:1时,氨气的转化率最小,即曲线c代表c(CH3OH):c(NH3)=1:1;
②温度一定,投料比一定,该反应前后气体系数之和相同,即压强不影响平衡,所以需要及时移去产物,使平衡正向移动,可以增大氨气的转化率;
③根据第①题可知c(CH3OH):c(NH3)=2:1投料时转化率对应的曲线为b,则443K为氨气的平衡转化率为25%,起始浓度c(NH3)=2mol/L,则c(CH3OH)=4mol/L,列三段式有:
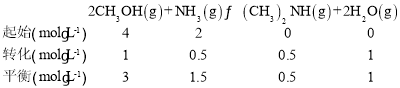
恒容密闭容器中体积分数和浓度占比相等,所以(CH3)2NH的体积分数为![]() =8.3%(或
=8.3%(或![]() );平衡常数K=
);平衡常数K=![]() =
=![]() 或0.037;
或0.037;
(3)步骤①中Cl-转化为Cl·,Cl-需要失去电子,所以为阳极,电极反应式为Cl--e-= Cl·;③在碱性电解液中,CH3Cl转化为目标产物CH3OH根据元素守恒可得离子方程式为:CH3Cl+OH-= CH3OH+Cl-;维持电流强度为1.5A,电解2小时,时间为7200s,F=96500Cmol-1,则转移电子![]() mol,左侧电极生成甲醇的过程存在数量关系:CH4~2Cl·~CH3Cl~CH3OH~2e-,所以生成的甲醇的物质的量为(
mol,左侧电极生成甲醇的过程存在数量关系:CH4~2Cl·~CH3Cl~CH3OH~2e-,所以生成的甲醇的物质的量为(![]() )mol,质量为(
)mol,质量为(![]() )mol×32g/mol=1.8g。
)mol×32g/mol=1.8g。

【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
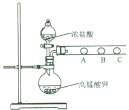
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。 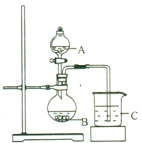
【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO