题目内容
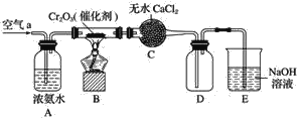
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
【答案】溶液NH3的酚酞 加热时NH3·H2O分解,溶液的碱性减弱,溶液的颜色逐渐变浅 溶有SO2的品红 SO2具有漂白性,SO2与品红溶液化合成不稳定的无色物质,加热时该不稳定的无色物质受热分解,SO2逸出,品红溶液又恢复红色
【解析】
(1)红色溶液加热后颜色变浅,说明该溶液加热时易分解,该溶液可能是溶有NH3的酚酞溶液 ,NH3的水溶液呈碱性,使酚酞变红,加热时NH3·H2O分解,溶液的碱性减弱,所以溶液的颜色变浅,方程式为:NH3·H2O ![]() NH3↑+ H2O;
NH3↑+ H2O;
(2)某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,说明加热时产生的气体可以使红色溶液变为无色,同时生成的无色物质不稳定,很容易联想到SO2的漂白原理,所以无色溶液可能为溶有SO2的品红溶液,加热时溶液由无色变为红色的原因是:SO2具有漂白性,SO2与品红溶液化合成不稳定的无色物质,加热时该不稳定的无色物质受热分解,SO2逸出,品红溶液又恢复红色。

 阅读快车系列答案
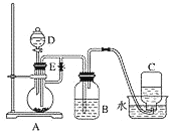
阅读快车系列答案【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
【题目】下列对生铁片锈蚀对比实验的分析正确的是( )
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A.对比实验①②③,说明苯能隔绝O2
B.实验①中,生铁片未见明显锈蚀的主要原因是缺少O2
C.实验②中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
D.实验③中,属于铁的吸氧腐蚀,负极反应:O2+4e-+2H2O=4OH-