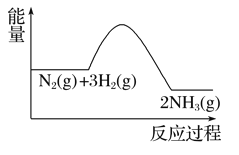
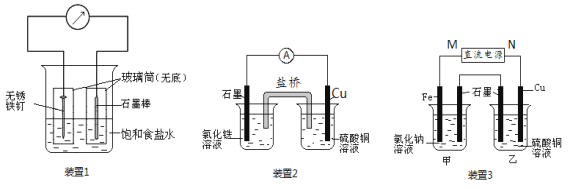
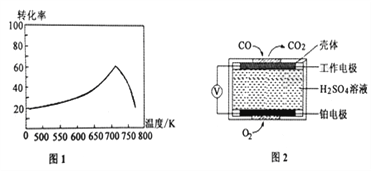
题目内容
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
【答案】C
【解析】A、二氧化锰只跟浓盐酸反应,因为二氧化锰是过量,随着反应的进行,盐酸浓度降低,反应停止,因此产生氯气的量小于1mol,故A错误;B、氯气中混有的杂质为HCl和水蒸气,依次通过饱和食盐水(除去HCl)、浓硫酸(除去水蒸气),因为氯气与碱石灰反应,因此不能用碱石灰干燥氯气,故B错误;C、发生的反应是MnO3+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,MnO2中Mn的化合价降低,因此MnO2作氧化剂,盐酸中Cl的化合价升高,HCl作还原剂,故C正确;D、氯气的密度大于空气的密度,因此用向上排空气法收集,因为氯气溶于水,因此不能用排水法收集,应用排饱和食盐水法收集,故D错误。
MnCl2+Cl2↑+2H2O,MnO2中Mn的化合价降低,因此MnO2作氧化剂,盐酸中Cl的化合价升高,HCl作还原剂,故C正确;D、氯气的密度大于空气的密度,因此用向上排空气法收集,因为氯气溶于水,因此不能用排水法收集,应用排饱和食盐水法收集,故D错误。

练习册系列答案
相关题目