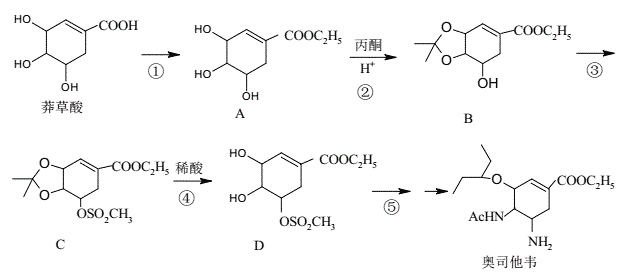
题目内容
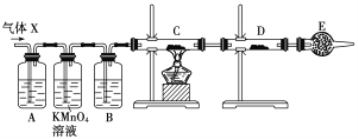
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
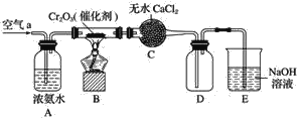
(1)B中发生反应的化学方程式是________________________________。
(2)证明氨气发生了催化氧化的现象是____________________________。
(3)写出(2)中反应的化学方程式______________________。
(4)装置E作用是________________________________________。
【答案】4NH3+5O2![]() 4NO+6H2O D中广口瓶中有红棕色气体 2NO+O2=== 2NO2 氢氧化钠溶液吸收有毒气体氮的氧化物,防止污染空气
4NO+6H2O D中广口瓶中有红棕色气体 2NO+O2=== 2NO2 氢氧化钠溶液吸收有毒气体氮的氧化物,防止污染空气
【解析】
在A中空气将氨水中的部分氨气带出,在B中NH3在Cr2O3催化下与O2反应产生NO和H2O,未反应的NH3及反应产生的H2O被C中CaCl2的吸收,NO与D中O2反应产生NO2,NO、NO2会被E中NaOH反应消耗掉,防止污染大气。
(1)装置B中发生的反应是氨的催化氧化反应,反应方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)NH3发生氧化反应,其产物之一NO极易与O2反应生成NO2,该气体是红棕色气体,所以装置B中反应后的气体经C中CaCl2后,未反应的NH3及反应产生的H2O被无水CaCl2吸收,进入装置D中,发生反应:2NO+O2=2NO2,所以证明氨气发生了催化氧化的现象是装置D中广口瓶内有红棕色气体产生;
(3)在上述(2)中反应的化学方程式是2NO+O2=2NO2;
(4)装置E的作用是氢氧化钠溶液吸收有毒气体氮的氧化物,防止污染空气。

练习册系列答案
相关题目