题目内容
【题目】(1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________、中心原子的杂化形式为________。LiAlH4中,存在_________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
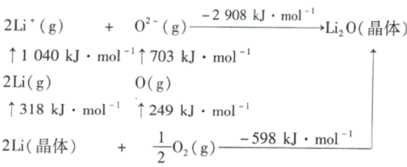
可知,Li原子的第一电离能为_________kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
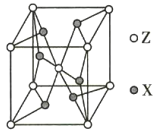
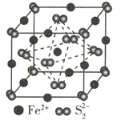
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加德罗常数的值为NA,则Li2O的密度为___________g·cm-3(列出计算式)。
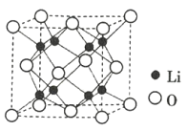
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
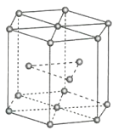
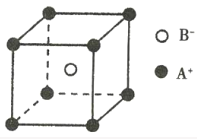
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________nm。
【答案】正四面体 sp3 ab 520 498 2908 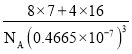 六方最密堆积
六方最密堆积 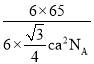
![]() ×1021
×1021 ![]() a
a
【解析】
(1)①LiAlH4中阴离子中Al原子价层电子对个数=4+![]() =4,且不含有孤电子对,根据价层电子对互斥理论判断其空间构型为正四面体形,中心原子杂化方式为sp3杂化;LiAlH4中,阴、阳离子之间存在离子键、Al和H原子之间存在极性共价键、配位键,共价键、配位键都是σ键,所以含有的化学键为离子键、σ键,合理选项是ab;
=4,且不含有孤电子对,根据价层电子对互斥理论判断其空间构型为正四面体形,中心原子杂化方式为sp3杂化;LiAlH4中,阴、阳离子之间存在离子键、Al和H原子之间存在极性共价键、配位键,共价键、配位键都是σ键,所以含有的化学键为离子键、σ键,合理选项是ab;
②锂原子的第一电离能是指1 mol气态锂原子失去1 mol电子变成l mol气态锂离子所吸收的能量,即为1040 kJ/mol÷2=520 kJ/mol;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249 kJ/mol×2=498 kJ/mol;晶格能是指气态离子结合生成1 mol晶体所释放的能量或l mol晶体断裂离子键形成气态离子所吸收的能量,由图示可知Li2O的晶格能为2908 kJ/mol;
③1个Li2O晶胞含O的个数为![]() ,含Li的个数为8,1 cm=107 nm,代入密度公式计算可得Li2O的密度ρ=
,含Li的个数为8,1 cm=107 nm,代入密度公式计算可得Li2O的密度ρ=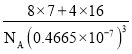 g/cm3;
g/cm3;
(2)由图示,堆积方式为六方最紧密堆积;为了计算的方便,选取该六棱柱结构进行计算。六棱柱顶点的原子是6个六棱柱共用的,面心是两个六棱柱共用,所以该六棱柱中的锌原子为12×![]() +2×
+2×![]() +3=6个,所以该结构的质量m=
+3=6个,所以该结构的质量m=![]() g,该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为a cm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为6×
g,该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为a cm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为6×![]() a2 cm2,所以体积为6×
a2 cm2,所以体积为6×![]() a2 cm3,则晶体的密度ρ=
a2 cm3,则晶体的密度ρ=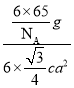 =
=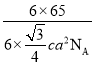 g/cm3;
g/cm3;
(3)晶胞边长为a nm=a×10-7 cm,晶胞的体积V=( a×10-7cm)3,该晶胞中Fe2+的个数为:1+12×![]() =4,S22-的个数为:8×
=4,S22-的个数为:8×![]() +6×
+6×![]() =4,其晶体密度ρ=
=4,其晶体密度ρ=![]() =
=![]() ×1021 g/cm3;根据晶胞结构,S22-所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的
×1021 g/cm3;根据晶胞结构,S22-所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的![]() ,故该正八面体的边长为
,故该正八面体的边长为![]() a nm。
a nm。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子排布图为__。
(2)已知电离能:I2(Ti)=1310kJ·mol-1,I2(K)=3051kJ·mol-1。I2(Ti)<I2(K),其原因为__。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
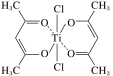
①钛的配位数为__,碳原子的杂化类型__。
②该配合物中存在的化学键有__(填字母)。
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)钛与卤素形成的化合物熔、沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是__。
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_。阴离子的立体构型为__。
![]()
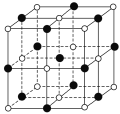
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg·cm-3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为___pm。(用含ρ、NA的代数式表示)
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
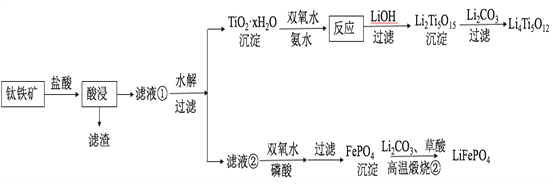
回答下列问题:
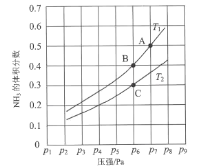
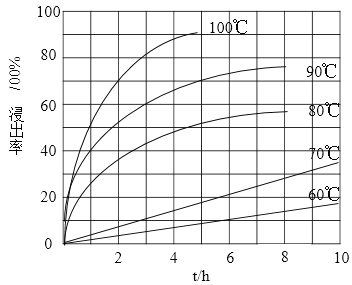
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。