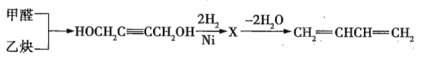
ЬтФПФкШн
ЁОЬтФПЁПWЁЂXЁЂYЁЂZЮЊдзгађЪ§вРДЮдіДѓЕФЧАЫФжмЦкдЊЫиЃЌдЊЫиWЪЧгюжцжазюЗсИЛЕФдЊЫиЃЌдЊЫиXЕФдзгЕФзюЭтВуЕчзгЪ§ЪЧЦфФкВуЕчзгЪ§ЕФ3БЖЃЌдЊЫиZЕФЛљЬЌдзгКЫЭтЕчзгга24жждЫЖЏзДЬЌЃЌYЁЂXЁЂZВЛдкЭЌвЛжмЦкЃЌЧвдЊЫиYЕФЛљЬЌдзгКЫЭтpЕчзгБШsЕчзгЖр5ИіЁЃ
(1)ZЕФЛљЬЌдзгЕФКЫЭтЕчзгХХВМЪНЮЊ____________________ЁЃ
(2)ZЕФбѕЛЏЮяЪЧЪЏгЭЛЏЙЄжаживЊЕФДпЛЏМСжЎвЛЃЌПЩДпЛЏвьБћБНСбЛЏЩњГЩБНКЭБћЯЉ
Ђй1 molБћЯЉЗжзгжаКЌга![]() Мќгы
Мќгы![]() МќЪ§ФПжЎБШЮЊ__________________ЁЃ
МќЪ§ФПжЎБШЮЊ__________________ЁЃ
ЂкБНЗжзгжаЬМдзгЕФдгЛЏРраЭЮЊ_________________ЁЃ
ЂлZЕФвЛжжбѕЛЏЮяZO5жаЃЌZЕФЛЏКЯМлЮЊ+6ЃЌдђЦфжаЙ§бѕМќЕФЪ§ФПЮЊ______________ЁЃ
(3)WЁЂXЁЂYШ§жждЊЫиЕФЕчИКадгЩаЁЕНДѓЕФЫГађЮЊ_________________ЃЈгУдЊЫиЗћКХБэЪОЃЉЁЃ
(4)ZY3ЕФШлЕуЮЊ1152ЁцЃЌЦфдкШлШкзДЬЌЯТФмЙЛЕМЕчЃЌОнДЫПЩХаЖЯZY3ОЇЬхЪєгк____________ЃЈЬюОЇЬхРраЭЃЉЁЃ
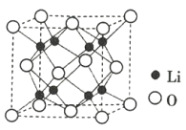
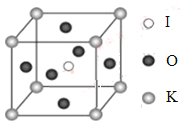
(5)ZX2ОЇЬхЕФОЇАћНсЙЙШчЭМЫљЪОЁЃШєИУЛЏКЯЮяЕФЯрЖдЗжзгжЪСПЮЊMЃЌОЇАћБпГЄЮЊa pmЃЌАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNAЃЌдђИУОЇЬхЕФУмЖШЮЊ_________ g/cm3ЁЃ
ЁОД№АИЁП[Ar]3d54s1Лђ1s22s22p63s23p63d54s1 8ЃК1 sp2дгЛЏ 2 HЃМClЃМO РызгОЇЬх ![]() ЁС1030
ЁС1030
ЁОНтЮіЁП
WЁЂXЁЂYЁЂZЮЊдзгађЪ§вРДЮдіДѓЕФЧАЫФжмЦкдЊЫиЃЌдЊЫиWЪЧгюжцжазюЗсИЛЕФдЊЫиЃЌWЮЊHЃЛдЊЫиXЕФдзгзюЭтВуЕчзгЪ§ЪЧЦфФкВуЕФ3БЖЃЌXОпга2ИіЕчзгВуЃЌЗћКЯЕчзгХХВМЙцТЩЃЌКЫЭтЕчзгХХВМЮЊ2ЁЂ6ЃЌдђXЮЊOЃЛдЊЫиZЕФЛљЬЌдзгКЫЭтЕчзгга24жждЫЖЏзДЬЌЃЌZЮЊCrЃЛYЁЂXЁЂZВЛдкЭЌвЛжмЦкЃЌЧвYдзгКЫЭтpЕчзгБШsЕчзгЖр5ИіЃЌYЮЛгкЕкШ§жмЦкЃЌ3pЩЯга5ИіЕчзгЃЌдђYЮЊClЃЌвдДЫРДНтД№ЁЃ
ИљОнЬтИјаХЯЂЭЦЖЯЃЌWЮЊHЃЌXЮЊOЃЌYЮЊClЃЌZЮЊCrдЊЫиЁЃ
(1)CrЪЧ24КХдЊЫиЃЌИљОнЙЙдьдРэЃЌПЩжЊCrЕФЛљЬЌдзгЕФКЫЭтЕчзгХХВМЪНЮЊ[Ar]3d54s1Лђ1s22s22p63S23p63d54s1ЃЛ
(2)ЂйБћЯЉНсЙЙМђЪНЮЊCH2=CH-CH3ЃЌЗжзгжаЕФЕЅМќЖМЪЧІвМќЃЌЫЋМќжага1ИіІвМќКЭ1ИіІаМќЃЌЫљвд1ИіБћЯЉЗжзгжаКЌга8ИіІвМќЃЌ1ИіІаМќЃЌ1 molБћЯЉЗжзгжаКЌгаІвМќгыІаМќЪ§ФПжЎБШЮЊ8ЃК1ЃЛ
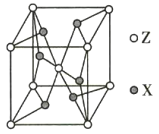
ЂкБНЗжзгНсЙЙМђЪНЮЊЃК![]() ЃЌЗжзгЪНЪЧC6H6ЃЌЗжзгжаУПИіЬМдзгаЮГЩ3ИіІвМќЃЌВЛКЌЙТЕчзгЖдЃЌЙЪБНЗжзгжаЬМдзгЕФдгЛЏРраЭЮЊsp2дгЛЏЃЛ
ЃЌЗжзгЪНЪЧC6H6ЃЌЗжзгжаУПИіЬМдзгаЮГЩ3ИіІвМќЃЌВЛКЌЙТЕчзгЖдЃЌЙЪБНЗжзгжаЬМдзгЕФдгЛЏРраЭЮЊsp2дгЛЏЃЛ
ЂлZЕФвЛжжбѕЛЏЮяZO5(CrO5)жаЃЌЩшЙ§бѕМќЕФЪ§ФПЮЊxЃЌдђ-2МлбѕдзгЕФИіЪ§ЪЧ5-2xЃЌCrЕФЛЏКЯМлЮЊ+6ЃЌдђИљОнЛЏКЯЮяжае§ИКЛЏКЯМлДњЪ§КЭЮЊ0ПЩжЊЃЌ2x+(5-2x)ЁС2=6ЃЌНтЕУx=2ЃЌдђЙ§бѕМќЕФЪ§ФПЮЊ2ЃЛ
(3)WЮЊHЃЌXЮЊOЃЌYЮЊClЃЌдЊЫиЕФЗЧН№ЪєадOЃОClЃОHЃЌдЊЫиЕФЗЧН№ЪєаддНЧПЃЌЦфЕчИКаддНДѓЃЌдђWЁЂXЁЂYШ§жждЊЫиЕФЕчИКадгЩаЁЕНДѓЕФЫГађЮЊHЃМClЃМOЃЛ
(4)ZY3ЕФШлЕуЮЊ1152ЁцЃЌЦфдкШлШкзДЬЌЯТФмЙЛЕМЕчЃЌОнДЫПЩХаЖЯZY3ОЇЬхЪєгкРызгОЇЬхЃЛ
(5)ИУОЇАћЮЊCrO2ЃЌгЩЭМПЩжЊCrЮЛгкОЇАћЖЅЕуКЭЬхаФФкЃЌOдзгЮЛгкУцЩЯКЭЬхФкЃЌИУОЇАћжаКЌгаCrдзгЪ§ЮЊ1+8ЁС![]() =2ЃЌКЌгаOдзгЪ§ЮЊ4ЁС
=2ЃЌКЌгаOдзгЪ§ЮЊ4ЁС![]() +2=4ЃЌвЛИіОЇАћжаКЌга2ИіCrЃЌ4ИіOдзгЃЌКЌга2ИіCrO2ЃЌШєИУЛЏКЯЮяЕФЯрЖдЗжзгжЪСПЮЊMЃЌдђОЇЬхУмЖШІб=
+2=4ЃЌвЛИіОЇАћжаКЌга2ИіCrЃЌ4ИіOдзгЃЌКЌга2ИіCrO2ЃЌШєИУЛЏКЯЮяЕФЯрЖдЗжзгжЪСПЮЊMЃЌдђОЇЬхУмЖШІб=![]() g/cm3=
g/cm3=![]() ЁС1030 g/cm3ЁЃ
ЁС1030 g/cm3ЁЃ

ЁОЬтФПЁПЯрЭЌЮТЖШЁЂЯрЭЌШнЛ§ЕФЫФИіУмБеШнЦїжаНјааЭЌбљЕФПЩФцЗДгІЃК2X(g)+Y(g)![]() 3W(g)+2Z(g) ЁїH=ЉQ KJ/molЃЌЦ№ЪМЪБГфШыЦјЬхЕФЮяжЪЕФСПМАЦНКтЪБЬхЯЕФмСПБфЛЏЪ§ОнШчБэЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
3W(g)+2Z(g) ЁїH=ЉQ KJ/molЃЌЦ№ЪМЪБГфШыЦјЬхЕФЮяжЪЕФСПМАЦНКтЪБЬхЯЕФмСПБфЛЏЪ§ОнШчБэЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
X | Y | W | Z | ЗДгІЬхЯЕФмСПБфЛЏ | |
Мз | 2mol | 1mol | ЗХГіa kJ/mol | ||
вв | 1mol | 1mol | ЗХГіb kJ/mol | ||
Бћ | 2mol | 2mol | ЗХГіc kJ/mol | ||
ЖЁ | 3mol | 2mol | ЮќЪеd kJ/mol |
A.XЕФзЊЛЏТЪЮЊЃКМзЃМввЃМБћ
B.c+dЃМQ
C.ЦНКтЪБЃЌМзШнЦїжаЕФЗДгІЫйТЪБШЖЁШнЦїжаЕФТ§
D.ЦНКтЪББћШнЦїжаZЕФЮяжЪЕФСПХЈЖШзюДѓ