题目内容
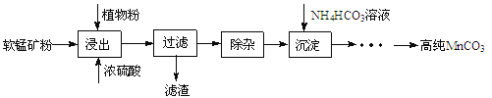
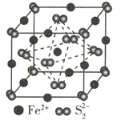
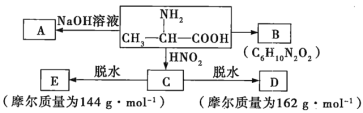
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
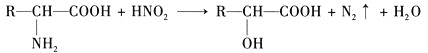
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
【答案】AC ![]() 使 Fe3+完全转化为 Fe(OH)3 沉淀除去 0.6 Mn2++HCO3-+NH3·H2O====MnCO3↓+NH4++H2O NH3 抑制 Cu2+的水解 重结晶
使 Fe3+完全转化为 Fe(OH)3 沉淀除去 0.6 Mn2++HCO3-+NH3·H2O====MnCO3↓+NH4++H2O NH3 抑制 Cu2+的水解 重结晶
【解析】
首先将两种矿物酸浸,![]() 中的
中的![]() 进入溶液,
进入溶液,![]() 杂质不溶于稀硫酸,辉铜矿中的
杂质不溶于稀硫酸,辉铜矿中的![]() 发生氧化还原反应得到不溶于硫酸的单质硫,过滤后得到滤液,调节pH使
发生氧化还原反应得到不溶于硫酸的单质硫,过滤后得到滤液,调节pH使![]() 转化为沉淀析出,加入碳酸氢铵和氨水的混合溶液,将溶液中的
转化为沉淀析出,加入碳酸氢铵和氨水的混合溶液,将溶液中的![]() 转化为碳酸锰固体析出,再加热使氨气挥发,过滤后得到碱式碳酸铜,加入硝酸转变为硝酸铜,再蒸发结晶即可得到产物,据此来分析本题即可。
转化为碳酸锰固体析出,再加热使氨气挥发,过滤后得到碱式碳酸铜,加入硝酸转变为硝酸铜,再蒸发结晶即可得到产物,据此来分析本题即可。
(1)A.粉碎矿石可以增大其与酸液的接触面积,提高浸取速率,A项正确;
B.延长酸浸时间不能加快浸取速率,B项错误;
C.升高温度,反应速率加快,C项正确;
答案选AC;
(2)根据分析,这一步的产物中有单质硫,写出离子方程式![]() ;
;
(3)调节浸出液的pH可以使溶液中的![]() 析出,防止产品中混入铁盐的杂质;设
析出,防止产品中混入铁盐的杂质;设![]() 在pH为4时的最大浓度为
在pH为4时的最大浓度为![]() ,则有
,则有![]() ,移项后解得
,移项后解得![]() ,即当pH为4时
,即当pH为4时![]() 的最大浓度为
的最大浓度为![]() ;
;
(4)氨水和![]() 先反应得到
先反应得到![]() ,然后再与
,然后再与![]() 得到碳酸锰沉淀,据此写出离子方程式
得到碳酸锰沉淀,据此写出离子方程式![]() ;
;
(5)根据流程不难发现![]() 在该过程中可以循环使用;
在该过程中可以循环使用;
(6)![]() 是弱碱阳离子,因此会发生水解,在加热时水解程度会显著增大,因此需要过量的酸来抑制其水解,否则最终无法得到硝酸铜晶体;
是弱碱阳离子,因此会发生水解,在加热时水解程度会显著增大,因此需要过量的酸来抑制其水解,否则最终无法得到硝酸铜晶体;
(7)最终得到的硝铜中仍会有少量硫酸铜等杂质,可以利用重结晶的方法除去硫酸铜。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
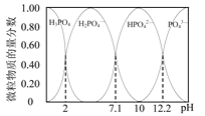
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
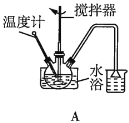
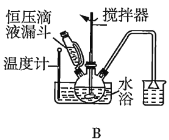
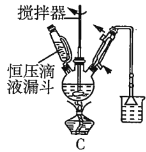
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。