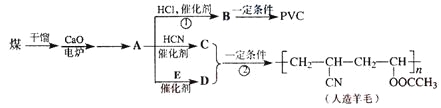
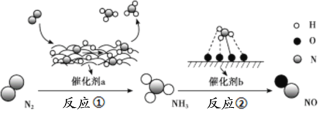
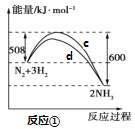
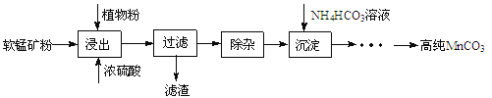
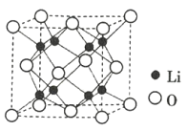
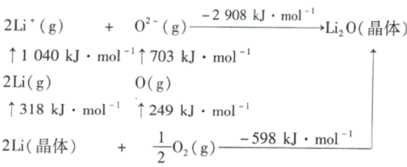��Ŀ����
����Ŀ���ѱ���Ϊ��21���͵Ľ��������ɳ��ֶ��ֻ��ϼۡ�������+4�۵�Ti��Ϊ�ȶ����ش��������⣺
��1����̬Tiԭ�ӵļ۵����Ų�ͼΪ__��
��2����֪�����ܣ�I2(Ti)=1310kJ��mol-1��I2(K)=3051kJ��mol-1��I2(Ti)<I2(K)����ԭ��Ϊ__��
��3����ij���������ڴ���ϩ���ۺϣ���ṹ��ͼ��ʾ��
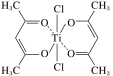
���ѵ���λ��Ϊ__��̼ԭ�ӵ��ӻ�����__��
�ڸ�������д��ڵĻ�ѧ����__(����ĸ)��
a.���ӽ� b.��λ�� c.������ d.���ۼ� e.���
��4������±���γɵĻ������ۡ��е����±���ʾ��
TiCl4 | TiBr4 | TiI4 | |
�۵�/�� | -24.1 | 38.3 | 155 |
�е�/�� | 136.5 | 233.5 | 377 |
����TiCl4��TiBr4��TiI4���۵�ͷе����һ���仯���ɵ�ԭ����__��
��5����֪TiO2��Ũ���ᷴӦ�����������ѣ��������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ��ͼ��ʾ���������ӻ�ѧʽΪ_�������ӵ����幹��Ϊ__��
![]()
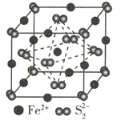
��6����֪TiN����ľ����ṹ��ͼ��ʾ�����þ������ܶ�Ϊ��g��cm-3�������ӵ�����ֵΪNA������Tiԭ����Nԭ�ӵ��������Ϊ___pm��(�ú�����NA�Ĵ���ʽ��ʾ)
���𰸡�![]() K+ʧȥ����ȫ������3p6���ӣ�Ti+ʧȥ����4s1���ӣ���Խ���ʧȥ����I2(Ti)<I2(K) 6 sp3��sp2 bd ���߾�Ϊ���Ӿ��壬�����ṹ���ƣ�������Է������������Ӽ������������ۡ��е����� TiO2+ ��������
K+ʧȥ����ȫ������3p6���ӣ�Ti+ʧȥ����4s1���ӣ���Խ���ʧȥ����I2(Ti)<I2(K) 6 sp3��sp2 bd ���߾�Ϊ���Ӿ��壬�����ṹ���ƣ�������Է������������Ӽ������������ۡ��е����� TiO2+ �������� ![]() ��1010
��1010
��������
��1����̬Tiԭ�ӵļ۵����Ų�ͼ�ɸ��ݹ���ԭ��������ԭ�������ع�����д��
��2��ȫ�������������ȫ�գ�������ȶ��Ľṹ���ƻ������Ľṹ��Ҫ������������γ������Ľṹ���ƽϴ���Ҫ����������
��3����λ��������ԭ����Χ����λԭ�ӵĸ�����̼ԭ�ӵ��ӻ����������γɵĻ�ѧ���йأ��γ�4������Ϊsp3�ӻ����γ�1��˫����2������Ϊsp2�ӻ����γ�1��������1������Ϊsp�ӻ���
��4�����Ӿ��壬��ɺͽṹ���ƣ���Է�������Խ���Ӽ�������Խ�����ʵ��ۡ��е�Խ�ߣ�
��5��SO42-�����幹�Ϳɸ��ݼ۲���ӶԻ��������Ʋ⣻
��6��������Tiԭ����Nԭ�ӵ��������Ϊ�����ⳤ�Ķ���֮һ�����ȸ���V=![]() �����������������ٿ����η����㾧���ⳤ��������ⳤ�˶���֮һ��
�����������������ٿ����η����㾧���ⳤ��������ⳤ�˶���֮һ��
��1����̬Tiԭ����4���۵��ӣ����ݹ���ԭ����4s�ܼ������ϵͣ�����������4s�ܼ���������3d�ܼ�����������ԭ���ͺ��ع���2������������4s�ܼ���1�����������״̬�෴��3d�ܼ���5�������ʣ��2������Ӧ��ռ�ݲ�ͬ�Ĺ����������״̬��ͬ���ʴ�Ϊ��![]() ��
��
��2��Ti+�Ļ�̬�����Ų�Ϊ[Ar]3d24s1����ʧȥ1�����ӣ�4s�������Ϊȫ��״̬�����ƽϴ���������I2(Ti)�ϵͣ�K+�Ļ�̬�����Ų�Ϊ[Ne]3s23p6����ʧȥ1�����ӣ����ƻ�3p6��ȫ����״̬����������I2(K)�ϸߣ��ʴ�Ϊ��K+ʧȥ����ȫ������3p6���ӣ�Ti+ʧȥ����4s1���ӣ���Խ���ʧȥ����I2(Ti)<I2(K)��
��3����Ti����λ��Ϊ6����̼���ӻ�����Ϊsp3��˫��̼���ӻ�����Ϊsp2���ʴ�Ϊ��6��sp3��sp2��
�ڸ�������д�����λ�����ۼ����ʴ�Ϊ��bd��
��4��TiCl4��TiBr4��TiI4���ۡ��е������ߣ���Ϊ���Ǿ�Ϊ���Ӿ��壬��ɺͽṹ���ƣ���Է�������Խ���Ӽ�������Խǿ���ۡ��е�Խ�ߣ��ʴ�Ϊ�����߾�Ϊ���Ӿ��壬�����ṹ���ƣ�������Է������������Ӽ������������ۡ��е����ߣ�
��5�����þ�̯��ȷ���������Ѿ����������ӵĻ�ѧʽ��ÿ��Tiԭ������2��Oԭ�ӣ�ÿ��Oԭ��ֻ��һ��������������Tiԭ����Oԭ�ӵĸ�����=1��(![]() ��2)=1��1�������ӵĻ�ѧʽΪTiO2+���������ѵ�������ΪSO42-������ԭ��S�ļ۲���Ӷ���=4+
��2)=1��1�������ӵĻ�ѧʽΪTiO2+���������ѵ�������ΪSO42-������ԭ��S�ļ۲���Ӷ���=4+![]() ��(8��4��2)=4��VSEPRģ��Ϊ�������壬û�йµ��Ӷԣ�����SO42-�����幹��Ϊ�������壬�ʴ�Ϊ��TiO2+���������壻
��(8��4��2)=4��VSEPRģ��Ϊ�������壬û�йµ��Ӷԣ�����SO42-�����幹��Ϊ�������壬�ʴ�Ϊ��TiO2+���������壻
��6��һ��TiN�����У�Tiԭ����=12��![]() +1=4��Nԭ����=6��
+1=4��Nԭ����=6��![]() +8��
+8��![]() =4��m(����)=m(Ti)+m(N)=
=4��m(����)=m(Ti)+m(N)=![]() =
=![]() g��V(����)=
g��V(����)=![]() =
= =
=![]() ���������ⳤ=
���������ⳤ=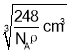 =
=![]() cm=
cm=![]() ��1010pm��������Tiԭ����Nԭ�ӵ��������=�������ⳤ��
��1010pm��������Tiԭ����Nԭ�ӵ��������=�������ⳤ��![]() =
=![]() ��1010pm��
��1010pm��![]() =
=![]() ��1010pm ���ʴ�Ϊ��
��1010pm ���ʴ�Ϊ��![]() ��1010��
��1010��![]()

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����������ˮ��Һ�еĵ���״�����Խ��ж���������Ʋ⡣
��1��25��ʱ������ĵ���ƽ�ⳣ�������ʾ��
Ka1 | Ka2 | |
HA | 1��10-4 | |
H2B | 1��10-2 | 5��10-6 |
��25��ʱ��0.100mol��L-1��NaA��Һ��H+��OH-��Na+��A-��HA�����ʵ���Ũ���ɴ�С��˳���ǣ�___��pH=8��NaA��Һ����ˮ�������c(OH-)=___mol��L-1��
��25��ʱ��0.100mol��L-1��NaHB��ҺpH___7��������___��
��25��ʱ����0.100mol��L-1��Na2B��Һ�еμ�����0.100mol��L-1��HA��Һ����Ӧ�����ӷ���ʽΪ___��
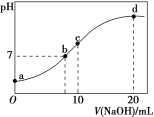
��2����֪25��ʱ����0.100mol��L-1��H3PO4��Һ�еμ�NaOH��Һ���������������ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ��
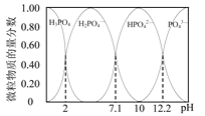
�ٵ���ҺpH��11��14ʱ����������Ӧ�����ӷ���ʽΪ��___��