题目内容
11.铜及其化合物在工农业生产及日常生活中应用非常广泛.某学习小组用粗铜(含杂质铁)制备氧化铜晶体(CuCl2•2H2O)的流程如下.粗铜$\stackrel{Cl_{2}}{→}$固体$\stackrel{加稀盐酸溶液}{→}$溶液Ⅰ$\stackrel{调节溶液pH}{→}$

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液Ⅰ之所以要调节溶液pH,目的是除去Fe3+且不引人杂质.调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤(填操作名称)、洗涤干燥.
(3)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)则该样品中CuCl2•2H2O的质量分数为$\frac{1.71cV}{m}$×100%(用含m,c,V的代数式表示,不用化简).如果达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)已知热化学方程式:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1;
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1.则由辉铜矿(Cu2S)制取铜的热化学方程式为3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
分析 (1)调节溶液的pH,除去Fe3+且不引人杂质,由表中的数据可知,理论上可选择pH最大范围是3.2≤pH<4.7;(2)由溶液Ⅱ制备CuCl2•2H2O晶体的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤、洗涤干燥;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,发生反应离子方程式计算分析;
(4)根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减.
解答 解:(l)调节溶液的pH,除去Fe3+且不引人杂质,由表中的数据可知,理论上可选择pH最大范围是3.2≤pH<4.7;
故答案为:3.2≤pH<4.7;
(2)由溶液Ⅱ制备CuCl2•2H2O晶体的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤、洗涤干燥,故答案为:过滤;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取mg试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用cmol/L Na2S2O3标准溶液滴定,重复2次,测得消耗标准液体积的平均值为VmL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3~2Cu2+
2 2
cmol/L×V×10-3L cV×10-3mol
试样中CuCl2•2H2O的质量百分数=$\frac{cV×10{\;}^{-3}mol×10×171g/mol}{mg}$×100%=$\frac{1.71cV}{m}$×100%,
如果达到滴定终点时,仰视滴定管读数,则消耗的Na2S2O3体积偏大,将使测定结果偏高,
故答案为:$\frac{1.71cV}{m}$×100%;偏高;
(4)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
②、2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
根据盖斯定律,①+②得,3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=(-768.2KJ•mol-1+116.0KJ•mol-1)=-652.2kJ•mol-1;
故答案为:3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
点评 本题考查盖斯定律得应用和物质制备,滴定实验的原理应用,滴定过程的反应原理和计算方法是解本题的关键,难度较大.

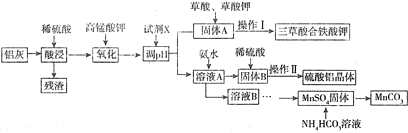
已知:生成氢氧化物的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.6 | 2.1 |
| 完全沉淀时 | 5.2 | 3.2 |
(1)为提高酸浸速率,应采用的措施是(答出两条)适当提高硫酸的浓度、加热、搅拌,残渣的主要成分是SiO2;
(2)写出氧化过程中反应的了新方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(3)试剂X的化学式是Al2O3或Al(OH)3,pH的调控范围是3.2≤pH<3.6;
(4)操作Ⅱ的晶体步骤为蒸发浓缩、降温结晶,过滤洗涤、低温干燥,若操作Ⅰ与操作Ⅱ相同,则洗涤三草酸合铁酸钾以获得干燥晶体的试剂最好是b;
a.先热水后酒精 b.先冷水后酒精 c.先酒精后热水 d.先酒精后冷水
(5)生成MnCO3沉淀的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
| A. | 可以在空气中燃烧 | |
| B. | 与氯气发生取代反应 | |
| C. | 不能使高锰酸钾溶液褪色 | |
| D. | 可以与溴水中的溴反应而使溴水褪色 |
| A. | SO2、O2 | B. | SO2、SO3 | C. | SO2、O2、SO3 | D. | O2、SO3 |
| A. | 将块状药品研细后再反应 | |
| B. | 食物储存在冰箱里 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用30% H2SO4溶液代替5% H2SO4溶液与锌粒反应 |
| A. | 用核磁共振氢谱能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 用红外光谱能区分CH3COOH和CH3COOCH2CH3 | |
| C. | 室温下,在水中的溶解度:苯酚>丙三醇>1-氯丁烷 | |
| D. | 由乙烷和丙烯组成的混合物共1mol,完全燃烧生成3molH2O |
| A. | 能使红色石蕊试纸显蓝色的溶液:K+、Fe2+、SO42-、NO3-、Cl- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl- | |
| D. | 加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3- |
| A. | 气体分子微粒的大小 | B. | 气体分子所含微粒的数目 | ||
| C. | 气体分子间平均距离的大小 | D. | 气体分子间作用力的大小 |
| A. | 废报纸 | B. | 废塑料 | C. | 废钢铁 | D. | 废电池 |