题目内容
16.下列说法不正确的是( )| A. | 用核磁共振氢谱能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 用红外光谱能区分CH3COOH和CH3COOCH2CH3 | |
| C. | 室温下,在水中的溶解度:苯酚>丙三醇>1-氯丁烷 | |
| D. | 由乙烷和丙烯组成的混合物共1mol,完全燃烧生成3molH2O |
分析 A.二者含有的H原子种类不同;
B.CH3COOH和CH3COOCH2CH3含有的官能团不同;
C.丙三醇易溶于水;
D.乙烷和丙烯分子中都含有6个H原子.
解答 解:A.HCOOCH3和HCOOCH2CH3含有的H原子种类分别为2、3,可用核磁共振氢谱能区分,故A正确;
B.CH3COOH和CH3COOCH2CH3含有的官能团不同,分别为羧基和酯基,可用红外光谱能区分,故B正确;
C.丙三醇可与水形成氢键,易溶于水,而苯酚在常温下微溶于水,故C错误;
D.乙烷和丙烯分子中都含有6个H原子,则混合物共1mol,完全燃烧生成3molH2O,故D正确.
故选C.
点评 本题考查有机物的结构和性质,侧重于有机物的检验和鉴别的考查,注意把握有机物的结构和官能团的性质,难道不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
7.下列气体中,无色无味的是( )
| A. | SO2 | B. | NO2 | C. | Cl2 | D. | N2 |
4.下列说法中正确的是( )
| A. | 在25℃的纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性 | |
| B. | 溶液中若c(H+)>10-7 mol/L,则c(H+)>c(OH-),溶液显酸性 | |
| C. | c(H+)越大,则pH值越大,溶液的碱性越强 | |
| D. | pH值为0的溶液中c(H+)=0 mol/L |
11.铜及其化合物在工农业生产及日常生活中应用非常广泛.某学习小组用粗铜(含杂质铁)制备氧化铜晶体(CuCl2•2H2O)的流程如下.
粗铜$\stackrel{Cl_{2}}{→}$固体$\stackrel{加稀盐酸溶液}{→}$溶液Ⅰ$\stackrel{调节溶液pH}{→}$
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液Ⅰ之所以要调节溶液pH,目的是除去Fe3+且不引人杂质.调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤(填操作名称)、洗涤干燥.
(3)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)则该样品中CuCl2•2H2O的质量分数为$\frac{1.71cV}{m}$×100%(用含m,c,V的代数式表示,不用化简).如果达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)已知热化学方程式:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1;
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1.则由辉铜矿(Cu2S)制取铜的热化学方程式为3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
粗铜$\stackrel{Cl_{2}}{→}$固体$\stackrel{加稀盐酸溶液}{→}$溶液Ⅰ$\stackrel{调节溶液pH}{→}$

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液Ⅰ之所以要调节溶液pH,目的是除去Fe3+且不引人杂质.调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤(填操作名称)、洗涤干燥.
(3)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)则该样品中CuCl2•2H2O的质量分数为$\frac{1.71cV}{m}$×100%(用含m,c,V的代数式表示,不用化简).如果达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)已知热化学方程式:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1;
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1.则由辉铜矿(Cu2S)制取铜的热化学方程式为3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
8.在相同条件下总质量为2g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
| A. | 2g | B. | 1g | C. | 18g | D. | 无法确定 |
5.在强碱性的无色溶液中能大量共存的离子组是( )
| A. | K+、Mg2+、MnO4-、Cl- | B. | Na+、Ba2+、NO3-、Cl- | ||
| C. | Na+、H+、SO42-、Cl- | D. | Ca2+、K+、CO32-、NO3- |
6.在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )
| A. | Na+、Al3+、SO42-、NO3- | B. | Ba2+、Na+、SO42-、NO3- | ||
| C. | K+、Mg2+、MnO4-、SO42- | D. | K+、Na+、NO3-、HCO3- |
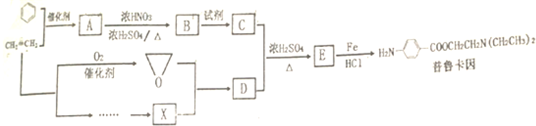
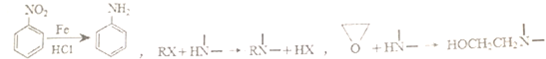
 .
.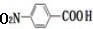 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.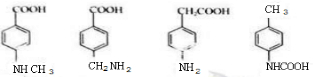 .
.