题目内容
3.下列各组离子在指定条件下,一定能大量共存的是( )| A. | 能使红色石蕊试纸显蓝色的溶液:K+、Fe2+、SO42-、NO3-、Cl- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl- | |
| D. | 加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3- |
分析 A.能使红色石蕊试液显蓝色的溶液呈碱性;
B.能使碘化钾淀粉试纸变蓝色的溶液具有强氧化性;
C.水电离出的c(H+)=10-12mol/L的溶液呈酸性或碱性;
D.加入铝条有氢气生成的溶液呈酸性或强碱性,但不能是强氧化性酸溶液.
解答 解:A.能使红色石蕊试液显蓝色的溶液呈碱性,Fe2+、OH-生成沉淀而不能大量共存,故A错误;
B.能使碘化钾淀粉试纸变蓝色的溶液具有强氧化性,S2-易被氧化而不能大量共存,故B错误;
C.水电离出的c(H+)=10-12mol/L的溶液呈酸性或碱性,无论酸性还是碱性条件下,这几种离子之间不反应且和氢离子或氢氧根离子都不反应,所以能大量共存,故C正确;
D.加入铝条有氢气生成的溶液呈酸性或强碱性,但不能是强氧化性酸溶液,无论酸性还是碱性条件下HCO3-都不能大量共存,碱性条件下不能大量存在NH4+,酸性条件下,硝酸根离子和铝反应生成氮氧化物而不是氢气,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应、氧化还原反应,易错选项是D,注意酸性条件下硝酸根离子具有强氧化性.

练习册系列答案
相关题目
14.在一定温度下,将1molCO和1mol水蒸气放入一容积固定的密闭容器中,反应H2O(g)+CO(g)?CO2(g)+H2(g)平衡后,得到0.6molCO2,再通入0.4mol水蒸气,达到平衡后,CO2的物质的量可能为( )
| A. | 1.0mol | B. | 0.7mol | C. | 0.6mol | D. | 0.4mol |
11.铜及其化合物在工农业生产及日常生活中应用非常广泛.某学习小组用粗铜(含杂质铁)制备氧化铜晶体(CuCl2•2H2O)的流程如下.
粗铜$\stackrel{Cl_{2}}{→}$固体$\stackrel{加稀盐酸溶液}{→}$溶液Ⅰ$\stackrel{调节溶液pH}{→}$
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液Ⅰ之所以要调节溶液pH,目的是除去Fe3+且不引人杂质.调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤(填操作名称)、洗涤干燥.
(3)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)则该样品中CuCl2•2H2O的质量分数为$\frac{1.71cV}{m}$×100%(用含m,c,V的代数式表示,不用化简).如果达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)已知热化学方程式:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1;
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1.则由辉铜矿(Cu2S)制取铜的热化学方程式为3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
粗铜$\stackrel{Cl_{2}}{→}$固体$\stackrel{加稀盐酸溶液}{→}$溶液Ⅰ$\stackrel{调节溶液pH}{→}$

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液Ⅰ之所以要调节溶液pH,目的是除去Fe3+且不引人杂质.调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶、过滤(填操作名称)、洗涤干燥.
(3)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)则该样品中CuCl2•2H2O的质量分数为$\frac{1.71cV}{m}$×100%(用含m,c,V的代数式表示,不用化简).如果达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)已知热化学方程式:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1;
2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1.则由辉铜矿(Cu2S)制取铜的热化学方程式为3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),故△H=-652.2kJ•mol-1.
18.下列说法正确的是( )
| A. | 按系统命名法,化合物 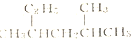 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. | 等质量的甲烷、乙烯、乙炔分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 苯酚、水杨酸(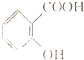 )和苯甲酸都是同系物 )和苯甲酸都是同系物 | |
| D. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 |
8.在相同条件下总质量为2g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
| A. | 2g | B. | 1g | C. | 18g | D. | 无法确定 |
12.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式不正确的是( )
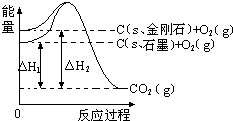

| A. | 石墨和金刚石的转化是化学变化 | |
| B. | 石墨的稳定性强于金刚石 | |
| C. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
13.下列热化学方程式及说法正确的是( )
| A. | CH4(g)+2O2 (g)=CO2(g)+2H2O(l)△H=-890KJ | |
| B. | 丁烷的燃烧热是2878 kJ/mol,则:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(g)△H=-2878kJ/mol | |
| C. | 2 mol氢气燃烧生成水蒸气放出484 kJ热量,则:H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242 kJ•mol-1 | |
| D. | CH3COOH(aq)+KOH(aq)=CH3COOK(aq)+H2O(l)△H=-akJ•mol-1,a为中和热的值 |
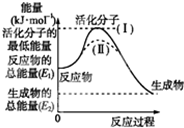 请认真观察图,然后回答问题:
请认真观察图,然后回答问题: