题目内容
8.下列比较错误的是( )| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H4SiO4 |
分析 A、同周期自左而右,元素的金属性减弱;
B、同周期自左而右,元素的非金属性增强;
C、元素金属性越强,最高价氧化物对应水化物的碱性越强,同周期自左而右,元素的金属性减弱;
D、非金属性越强,最高价氧化物对应水化物的酸性越强.同周期自左而右,元素的非金属性增强.
解答 解:A、同周期自左而右,元素的金属性减弱,所以金属性Na>Mg>Al,故A正确;
B、同周期自左而右,元素的非金属性增强,所以非金属性:Cl>S>P>Si,故B正确;
C、同周期自左而右,元素的金属性减弱,故金属性Na>Mg>Al,元素金属性越强,最高价氧化物对应水化物的碱性越强,故碱性NaOH>Mg(OH)2>Al(OH)3,故C正确;
D、同周期自左而右,元素的非金属性增强,非金属性Cl>S>P>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4>H3PO4>H2SiO3,而次氯酸和亚硫酸都是弱酸,无法应用规律,具体酸要结合电离常数分析,故D错误;
故选D.
点评 考查同周期、同主族元素性质的递变规律、元素周期律等,难度不大,注意元素周期律的掌握.

练习册系列答案
相关题目
3.某气态烃0.5mol能与1mol HCl完全加成,加成后产物分子中的氢原子又可被3mol Cl2完全取代,则此气态烃可能是( )
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
20.下列叙述正确的是( )
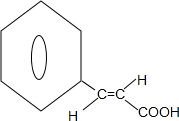
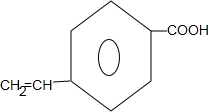
| A. | 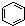 和 和 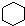 均是芳香烃, 均是芳香烃,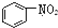 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| B. | 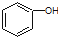 和 和 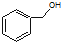 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| C. | 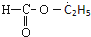 含有醛基,所以属于醛类 含有醛基,所以属于醛类 | |
| D. | 分子式为C4H10O的物质,可能属于醇类或醚类 |
17. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>T |
18.下列各项表达式中正确的是( )
| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: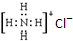 | |
| D. | Fe原子的结构示意图: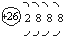 |
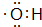 ;
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.
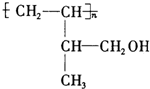 .
.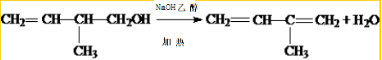 .
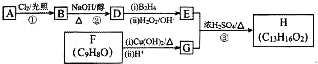
.

 ;
; +(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+
+(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+ ;
; .
.