题目内容
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
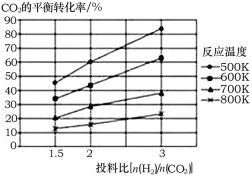
①ΔH1______(填写“>”或“<”)0;
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 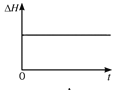 B.
B.  C.
C.  D.
D. 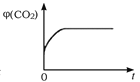
【答案】ΔH3-2ΔH2 K1K22 < 增大 不变 在相对较低的温度下可获得较高的SO2转化率,从而节约能源 0.44 A D
【解析】
(1)根据盖斯定律可知:反应①=反应③-2×反应②,可求ΔH1,K3;
(2)①观察图象,随温度升高,CO2的平衡转化率逐渐减小,结合平衡移动原理可知该反应为吸热还是放热反应;
②结合反应速率、平衡常数的影响因素回答即可;
(3)①条件的选择关键在于在使用较低成本,较少时间,而能够达到较高转化率;
②已知起始量3 mol CO、1molSO2,SO2的平衡转化率为40%,代入三段式即可求出各物质平衡量,即可求出K;
③结合平衡移动影响因素选择恰当的物质;
(4)可逆反应达到平衡状态时,各物质浓度、物质的量、百分含量等数据不再变化,特别注意混合气体平均相对分子质量等相关物理量的计算。
(1)根据盖斯定律可知:反应①=反应③-2×反应②,则ΔH1=ΔH3-2ΔH2,K3=K1×K22;
答案为:ΔH3-2ΔH2;K1K22;
(2)①由图可知,升高温度,CO2的平衡转化率降低,则正反应为放热反应,ΔH1<0,
答案为:<;
②增大压强,正逆反应速率均增大,K只与温度有关,平衡常数K不变;
答案为:增大;不变;
(3)①选择Fe2O3作催化剂,原因是在相对较低的温度下可获得较高的SO2转化率,从而节约能源;
答案为:在相对较低的温度下可获得较高的SO2转化率,从而节约能源;
②将3 mol CO、1molSO2,因为SO2的平衡转化率为40%,则△n(SO2)=1 mol×40%=0.4mol,将数据代入三段式: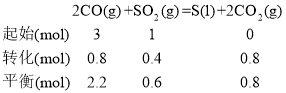 因为容积为2L,则平衡时c(CO)=1.1mol/L,c(SO2)=0.3mol/L,c(CO2)=0.4mol/L, 则
因为容积为2L,则平衡时c(CO)=1.1mol/L,c(SO2)=0.3mol/L,c(CO2)=0.4mol/L, 则![]() ;
;
答案为:0.44;
③增加CO浓度,可以使平衡正向移动,进而使SO2转化率增大;
答案为:A;
(4)A. 焓变指可逆反应完全反应的能量变化,与平衡移动无关,故A错;
B. 对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),由于气体总质量与气体总物质的量在任意时刻均不变,则混合气体平均相对分子质量为定值,故B错;
CO2(g)+H2(g),由于气体总质量与气体总物质的量在任意时刻均不变,则混合气体平均相对分子质量为定值,故B错;
C. 对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),由于气体总质量与容器体积不变,则气体密度为定值,故C错;
CO2(g)+H2(g),由于气体总质量与容器体积不变,则气体密度为定值,故C错;
D. CO2体积分数平衡前一直改变,平衡后不再变化,可以说明达到平衡状态,故D正确;
答案为:D。