题目内容
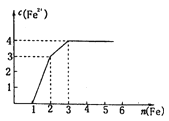
【题目】有一种有机物的键线式酷似牛,被称为牛式二烯炔醇(如图)。下列有关该化合物的说法不正确的是
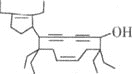
A.该分子中含有三种官能团
B.该物质能与金属钠反应产生氢气
C.该分子中甲基上的一氯代物有6种
D.1mol该物质最多可与![]() 发生加成反应
发生加成反应
【答案】C
【解析】
A. 该有机物含有醇羟基、碳碳双键、碳碳三键;
B. 该有机物含有醇羟基,可与金属钠反应;
C. 该分子含有四种环境的甲基;
D. 1mol该物质含有2mol碳碳双键和2mol碳碳三键。
A. 该有机物含有醇羟基、碳碳双键、碳碳三键,共3种官能团,A项正确,不符合题意;
B. 因为该有机物含有羟基,所以可以和金属钠反应产生氢气,B项正确,不符合题意;
C. 该分子含有四种环境的甲基,所以甲基上的一氯代物有4种,C项错误,符合题意;
D. 1mol该物质含有2mol碳碳双键和2mol碳碳三键,所以最多可与6molBr2发生加成反应, D项正确,不符合题意;
答案选C。

【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
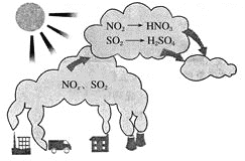
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
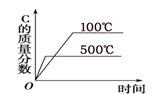
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
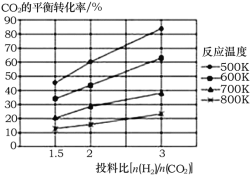
①ΔH1______(填写“>”或“<”)0;
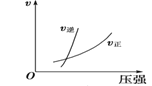
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
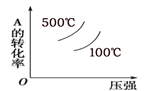
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;
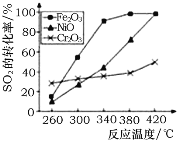
②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 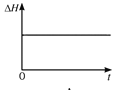 B.
B.  C.
C. 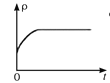 D.
D. 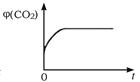
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
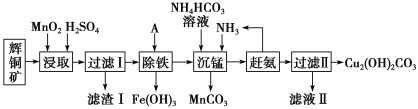
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。