题目内容
【题目】(1)今有常温下两种溶液:
(A)0.1mol·L-1NH3·H2O溶液 (B)0.1mol·L-1NH4Cl溶液
①溶液(A)的pH___7(填“>”“<”或“=”)。
②溶液(B)呈___性(填“酸”“碱”或“中”)。
③升高温度可以___(填“促进”或“抑制”)NH4Cl的水解。
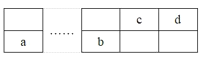
④氮及其化合物在工农业生产、生活中有着重要作用。如图是1molNO2和1molCO反应生成NO和CO2过程中能量变化示意图。
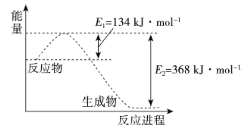
请写出NO2和CO反应的热化学方程式:___。
(2)已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)![]() C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
①升温时,C的反应速率___(填“加快”“减慢”或“不变”)。
②若平衡时,容器容积不变,增大压强,则平衡___。
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)①事实证明,原电池中发生的反应通常是放热的氧化还原反应。利用下列化学反应可以设计成原电池的是___。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=2H2O(l) △H<0
该原电池的负极是通入___(填“氢气”或“氧气”)的一极。
②以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应式为___。
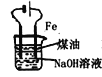
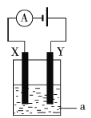
③电解原理在化学工业中有着广泛的应用。如图所示电解池中,a为NaCl溶液,X和Y是两块惰性电极板,则电解时的离子方程式为___。
【答案】> 酸 促进 NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol 加快 D C 氢气 2H2+4OH--4e-=4H2O 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【解析】
(1)①溶液(A)中存在电离平衡:NH3·H2O![]() NH4++OH-,所以溶液显碱性,pH>7;
NH4++OH-,所以溶液显碱性,pH>7;
②溶液(B)中存在水解平衡:NH4++ H2O![]() NH3·H2O+H+,所以溶液呈酸性;
NH3·H2O+H+,所以溶液呈酸性;
③水解反应为吸热反应,升温可以促进氯化铵的水解;
④根据图象知,反应物能量大于生成物总能量,所以该反应是放热反应,该反应的△H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol,所以其热化学反应方程式为:NO2(g)+CO(g)=NO (g)+CO2(g)△H=-234kJ/mol;
(2)①升高温度可以增大活化分子百分比,反应速率加快;
②保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动;
故选:D;
(3)①能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,该反应是吸热反应,所以不能设计成原电池,故错误;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,该反应不是氧化还原反应,所以不能设计成原电池,故错误;
C.2H2(g)+O2(g)=2H2O(l)△H<0,该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故正确;
综上所述选C;
原电池中负极发生氧化反应,所以负极是通入氢气的一极;
②电解质溶液为KOH溶液,所以负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-=4H2O;
③用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时电解质溶液中生成氢氧根离子,电池反应式为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案