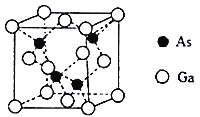
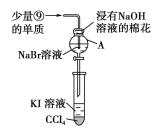
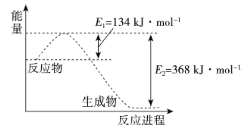
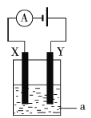
题目内容
【题目】实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为__________mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶__________。
②向容量瓶加水定容时眼睛俯视液面__________。
【答案】27.2 偏高 偏高
【解析】
(1)配制1.0 mol·L-1的稀硫酸溶液450mL,由于实验室没有450mL规格的容量瓶,按就近原则,应选择500mL规格的容量瓶。
用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液,需要计算所需量取的浓硫酸的体积,可利用稀释定律进行计算,即稀释前后,溶质的物质的量相等。
(2)分析误差时,可利用公式c=![]() ,根据操作时n、V发生的变化,判断c的变化。
,根据操作时n、V发生的变化,判断c的变化。
(1)浓硫酸的物质的量浓度![]() =18.4mol/L,需要用量筒量取的浓硫酸的体积为
=18.4mol/L,需要用量筒量取的浓硫酸的体积为![]() =27.2mL。答案为:27.2;
=27.2mL。答案为:27.2;
(2)①用量筒量取浓硫酸后,洗涤量筒,并把洗涤液转移到容量瓶,此时n偏大,则c偏高;答案为:偏高;
②向容量瓶加水定容时眼睛俯视液面,此时V偏小,c偏高;答案为:偏高。

练习册系列答案
相关题目