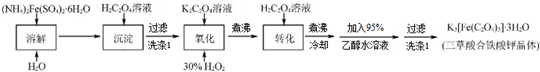
题目内容
3.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗.纯化工业级氧化锌(含有Fe(Ⅱ),Mn(Ⅱ),Ni(Ⅱ)等杂质)的流程如下:工业ZnO$→_{①}^{稀H_{2}SO_{4}}$浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$$\stackrel{过滤}{→}$滤液$→_{③}^{Zn}$$\stackrel{过滤}{→}$滤液$→_{④}^{Na_{2}CO_{3}}$$\stackrel{过滤}{→}$滤饼$→_{⑤}^{煅烧}$ZnO
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是Fe2+和Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O═MnO2↓+3Fe(OH)3↓+5H+;3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;加高锰酸钾溶液前,若pH较低,对除杂的影响是不会形成Fe(OH)3和MnO2沉淀.或无法除去Fe2+和Mn2+;
(2)反应③的反应类型为置换反应.过滤得到的滤渣中,除了过量的锌外还有Ni;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1g.则x等于1.
分析 纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,同时溶液中有MnO2生成,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液,生成碳酸锌沉淀,煅烧碳酸锌沉淀生成ZnO,据此分析解答.
解答 解:纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,同时溶液中有MnO2生成,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液,生成碳酸锌沉淀,煅烧碳酸锌沉淀生成ZnO,
(1)通过以上分析知,酸性高锰酸钾溶液具有强氧化性,将Fe2+、Mn2+氧化生成铁离子、MnO2,Zn2+和Ni2+与酸性高锰酸钾溶液不反应,所以反应②中除掉的杂质离子是Fe2+和Mn2+,发生的离子反应有MnO4-+3Fe2++7H2O═MnO2↓+3Fe(OH)3↓+5H+、3Mn2++2MnO4-+2H2O═5MnO2↓+4H+,如果溶液的pH较低,溶液呈酸性,则不能生成Fe(OH)3和MnO2沉淀而导致无法除去Fe2+和Mn2+,
故答案为:Fe2+和Mn2+;MnO4-+3Fe2++7H2O═MnO2↓+3Fe(OH)3↓+5H+; 3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;不会形成Fe(OH)3和MnO2沉淀,或无法除去Fe2+和Mn2+;
(2)过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生置换反应生成Ni,Ni不溶于水,所以滤渣中含有Ni和Zn,
故答案为:置换反应;Ni;
(3)如果沉淀洗涤不干净,则洗涤液中含有硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,其检验方法是:取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净,
故答案为:取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净;
(4)设ZnCO3•xZn(OH)2的物质的量为ymol,ZnCO3•xZn(OH)2煅烧得到ZnO,则固体质量减少的质量为二氧化碳、水的质量,n(ZnO)=$\frac{8.1g}{81g/mol}$=0.1mol,
根据固体质量减少的质量、ZnO的物质的量列方程式为
44y+18xy=11.2-8.1
y+xy=0.1
解得 x=1
y=0.05
故答案为:1.
点评 本题考查混合物的分离和提纯,侧重考查学生分析问题、解答问题能力,明确流程图中各个步骤发生的反应及溶液中存在的微粒,知道常见离子的检验方法及实验现象,题目难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应只可能有一种元素被氧化和一种元素被还原 | |
| B. | 表②中若生成标准状况下6.72LCl2,转移电子数为0.6NA | |
| C. | 由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. | 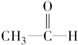 +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
| A. | 单质 | B. | 氧化物 | C. | 混合物 | D. | 纯净物 |
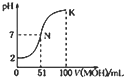 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )| A. | HA为一元强酸,NOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | K点所示溶液中c(A-)>c(M+) | |
| D. | K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
| A. | A原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A 与酸反应置换出的H2比1 mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |