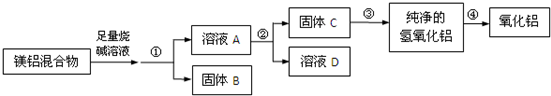
题目内容
8.下列反应中不属于加成反应的是( )| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. | 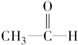 +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应.
解答 解:A、乙烯和水加成时,是将乙烯中的碳碳双键打开,然后将-H和-OH分别加入到打开的双键上,故为加成反应,故A错误;
B、1,3-丁二烯和氢气加成时,是将双键打开,将-H加到双键两端的碳原子上,属于加成反应,故B错误;
C、乙醛和氢气加成时,是将醛基中的碳氧双键打开,将-H分别加到碳原子和氧原子上,属于加成反应,故C错误;
D、乙烷和氯气反应时,是-Cl取代了乙烷中的-H,属于取代反应,故D正确.
故选D.
点评 本题考查学生对有机反应类型知识的掌握,难度不大,根据加成反应和取代反应的反应机理来分析判断.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
18.铜和其化合物是中学化学的重要学习内容.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
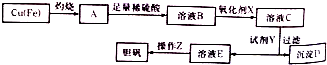
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
已知:
请回答:
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
16.为实现下列实验目的,下表提供的主要玻璃仪器和所用试剂合理的是( )
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
20.100mL 1mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 水 | ||
| C. | 硫酸钾溶液 | D. | 10 mL1mol•L-1 H2SO4 |
17.下列叙述错误的是( )
| A. | 可用铝制容器盛装稀硫酸 | B. | Na2O2可用作供氧剂 | ||
| C. | Fe2O3常用于制造红色油漆和涂料 | D. | Si可用于制造太阳能电池 |