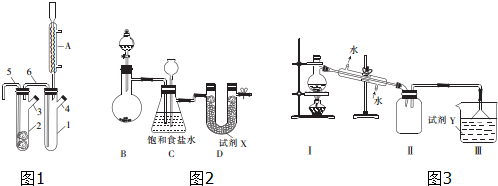
题目内容
13.K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾晶体)为草绿色晶体.溶于水,难溶于乙醇.110℃下失去结晶水,230℃分解:是制备负载型活性炭催化剂的主要原料.实验室利用(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸和铁酸钾晶体的部分实验过程如下:
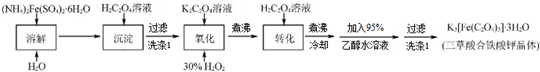
已知:沉淀FeC2O4•2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3K2C2O4═2K3[Fe(C2O4)3]+6H2O
(1)检验硫酸亚铁铵是否变质的试剂是KSCN;溶解时加几滴稀硫酸的目的是抑制Fe2+水解.
(2)检验硫酸亚铁铵溶液H2C2O4溶液反应生成FeC2O4•2H2O沉淀,写出该反应方程式:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O;沉淀过滤后,洗涤1的操作方法是向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作数次.
(3)在沉淀中加入饱和的K2C2O4溶液,并用40℃左右水溶加热,再向其汇总慢慢滴加足量的30%H2O2溶液,不断搅拌,此过程需保持温度在40℃左右,可能的原因是温度太高双氧水容易分解,温度太低反应速率太慢.加入30%过氧化氢溶液完全反应后,煮沸的目的是除去过量的双氧水
(4)洗涤2中所用洗涤试剂最合适的是C(填选项字母).
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是蒸馏,所用的主要玻璃仪器有蒸馏烧瓶、温度计(任写两种)等.
分析 由所给的流程可知:硫酸亚铁铵晶体溶于水后加入草酸生成FeC2O4•2H2O沉淀出来,此沉淀经氧化亚铁离子变为三价铁离子,然后制得所要的产品即可;
(1)亚铁离子变质为铁离子,铁离子利用KSCN溶液验证;亚铁离子在水溶液中水解,加入稀硫酸抑制水解;
(2)据所给反应物和生成物书写即可,依据洗涤沉淀的正确方法解答即可,洗涤需要多次,且水应浸没固体,待水自然流下;
(3)温度较高时,H2O2分解;
(4)依据信息“K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾晶体)为草绿色晶体.溶于水,难溶于乙醇”回答;
(5)分离乙醇和水的方法是蒸馏;蒸馏常用仪器是蒸馏烧瓶、温度计、冷凝管和牛角管、锥形瓶.
解答 解:(1)硫酸亚铁若变质,则被氧化为铁离子,铁离子与KSCN溶液显示血红色,溶解的过程中要加入几滴稀硫酸,目的是亚铁离子在水溶液中水解,加入稀硫酸抑制水解,故答案为:KSCN;抑制Fe2+水解;
(2)草酸与硫酸亚铁铵反应生成硫酸铵、硫酸和FeC2O4•2H2O沉淀,化学反应方程式为:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O
,洗涤沉淀的方法为:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作数次,故答案为:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O;
(3)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,温度过低反应速率小,反应后煮沸的目的是除去过量的双氧水,故答案为:温度太高双氧水容易分解,温度太低反应速率太慢;除去过量的双氧水;
(4)K3[Fe(C2O4)3]-3H2O(三草酸合铁酸钾晶体)为草绿色晶体.溶于水,难溶于乙醇,所以最好的洗涤试剂是乙醇,故答案为:C;
(5)乙醇和水互溶,利用蒸馏的方法分离乙醇和水,蒸馏所用的仪器为蒸馏烧瓶、温度计、冷凝管和牛角管和锥形瓶,故答案为:蒸馏; 蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶.
点评 本题主要考查溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.

| A. | 硝基苯的结构简式: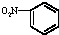 | B. | 乙烯的比例模型: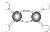 | ||
| C. | 过氧化氢的电子式: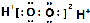 | D. | 硫离子的结构示意图: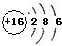 |
(1)准确称量4.1g含有少量中性易溶杂质的样品,配成250mL待测溶液.称量时样品可放在A(填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,不可选用B(填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化和滴液的流速,直到滴定终点.
(4)根据你所选择的指示剂,正确判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色.
(5)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4020mol•L-1,烧碱样品的纯度是98.05%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
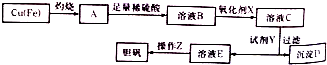
已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 燃烧一定要有氧气参加 | |
| C. | 吸热反应在常温下也有可能发生 | |
| D. | 氧化还原反应一定是放热反应 |