题目内容
【题目】物质的量是化学中常用的物理量,请完成以下有关计算:
(1)0.2 g H2含有________个H原子。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)100 mL硫酸钠溶液中n(Na+)=0.20 mol,则其中c(SO42-)=________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
(5)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量___g。
【答案】0.2NA 2∶1 1.0 mol/L 95 g/mol 24 11.2
【解析】
(1)先根据n=![]() 计算H2的物质的量,然后根据H2分子中含有的H原子个数计算H原子数目;
计算H2的物质的量,然后根据H2分子中含有的H原子个数计算H原子数目;
(2)先计算气体的物质的量的比,然后根据V=n·Vm确定气体的体积比;
(3)根据Na2SO4电离产生的Na+、SO42-的个数关系由Na+的物质的量计算出SO42-的物质的量,再根据c=![]() 计算c(SO42-);
计算c(SO42-);
(4)根据盐的组成由Cl-的物质的量确定盐的物质的量,结合n=![]() 计算氯化物的摩尔质量,再根据摩尔质量与物质式量关系计算金属元素的相对原子质量;
计算氯化物的摩尔质量,再根据摩尔质量与物质式量关系计算金属元素的相对原子质量;
(5)先计算CO的物质的量,然后根据反应方程式计算出反应产生的Fe的物质的量和质量。
(1)0.2 gH2的物质的量是n=![]() =0.1 mol,由于H2分子中含有2个H原子,则0.1 molH2中含有0.2 molH原子,含有的H原子数目为0.2NA;
=0.1 mol,由于H2分子中含有2个H原子,则0.1 molH2中含有0.2 molH原子,含有的H原子数目为0.2NA;
(2)由于在CO、CO2分子中含有的O原子数分别是1个、2个,所以标准状况下,含有相同氧原子数的CO和CO2的物质的量的比为2:1,由于V=n·Vm,所以气体的体积比等于气体的物质的量的比,故相同条件下CO、CO2的体积比等于2:1;
(3)Na2SO4电离产生Na+、SO42-个数比为2:1,由于n(Na+)=0.20 mol,所以n(SO42-)=0.10 mol,溶液的体积是0.1 L,所以c(SO42-)=![]() =
=![]() =1.0 mol/L;
=1.0 mol/L;
(4)二价金属的氯化物中含有0.2 mol Cl-,则氯化物的物质的量为0.1 mol,由于其质量是9.5 g,所以该金属氯化物的摩尔质量为M=![]() =95 g/mol;假设金属元素用符号R表示,该氯化物化学式为RCl2,R+2×35.5=95,所以R的相对原子质量为95-71=24;
=95 g/mol;假设金属元素用符号R表示,该氯化物化学式为RCl2,R+2×35.5=95,所以R的相对原子质量为95-71=24;
(5)6.72 L CO标准状况的CO的物质的量n(CO)=6.72 L÷22.4 L/mol=0.3 mol,CO与Fe2O3反应的方程式为:3CO+Fe2O3![]() 2Fe+3CO2;由于CO的物质的量是0.3 mol,则反应产生的Fe的物质的量是0.2 mol,则生成Fe的质量m(Fe)=0.2 mol×56 g/mol=11.2 g。
2Fe+3CO2;由于CO的物质的量是0.3 mol,则反应产生的Fe的物质的量是0.2 mol,则生成Fe的质量m(Fe)=0.2 mol×56 g/mol=11.2 g。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】二烯烃与溴反应制备多卤代物,反应的区域选择性在有机合成中具有重要意义。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反应原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列问题:
(1)△H3=_____________。
(2)1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为_________
(3)T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成产物 | 0% | 26% | 10% | 4% | 4% |
1,4加成产物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=_______。
(4)对于反应③,若要提高1,4-加成产物 ( )平衡体系中的物质量分数,可以采取的措施有_____
)平衡体系中的物质量分数,可以采取的措施有_____
A.适当升高温度 B.使用合适的催化剂
C.增大体系的压强 D.将1,4加成产物及时从体系分离
(5)反应 1,3-丁二烯二聚体的解聚为可逆反应:
 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
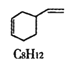
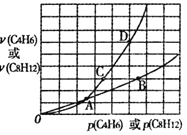
在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_____;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是______ ,理由是________。
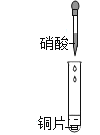
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
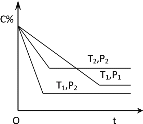
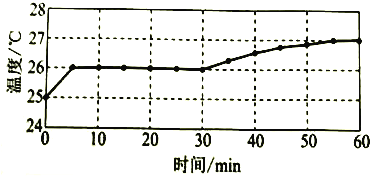
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
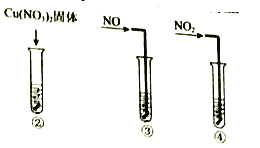
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
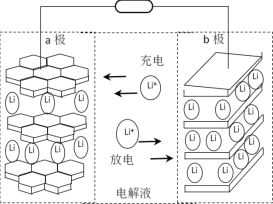
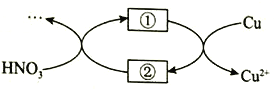
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。